题目内容
16.现有A、B、C、D四种金属片:①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;
②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C.
根据上述情况,下列说法中正确的是( )
| A. | 如果把B、D用导线连接后同时浸入稀硫酸中,则金属片D上有气泡产生 | |
| B. | 在在①中,金属片B发生还原反应 | |
| C. | ②中,金属片C作正极 | |
| D. | 上述四种金属的活动性由强到弱的顺序是:A>B>C>D |
分析 在原电池中,较活泼的金属作负极、较不活泼的金属作正极,
①作原电池负极的金属较活泼,易被腐蚀;
②负极上发生氧化反应、正极上发生还原反应;
③电子从负极沿导线流向正极;
据此判断金属活泼性强弱;
A.B的金属性大于D,如果把B、D用导线连接后同时浸入稀硫酸中,B作负极、D作正极;
B.负极上发生氧化反应;
C.负极上发生氧化反应、正极上发生还原反应;
D.根据以上分析金属活动性顺序.
解答 解:在原电池中,较活泼的金属作负极、较不活泼的金属作正极,
①作原电池负极的金属较活泼,易被腐蚀,把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解,则B作负极,金属活动性B>A;
②负极上发生氧化反应、正极上发生还原反应,把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应,则金属活动性C>D;
③电子从负极沿导线流向正极,把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C,则金属活动性A>C,
通过以上分析知,金属活动性强弱顺序是B>A>C>D,
A.B的金属性大于D,如果把B、D用导线连接后同时浸入稀硫酸中,B作负极、D作正极,则金属片D上有气泡产生,故A正确;
B.在①中,金属片B作负极,负极上失电子发生氧化反应,故B错误;
C.通过以上分析知,在②中,金属片C作负极、D作正极,故C错误;
D.通过以上分析知,上述四种金属的活动性由强到弱的顺序是:B>A>C>D,故D错误;
故选A.
点评 本题以原电池原理为载体考查了金属活泼性强弱的判断,根据电极上发生的反应、得失电子确定正负极,再结合金属的活泼性与正负极的关系分析解答,题目难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
6.X、Y为周期表VIA族的两种元素,下列叙述能说明X得电子能力比Y强的是( )
| A. | X元素的电子层数比Y的电子层数多 | |
| B. | X的氢化物的沸点比Y的氢化物的沸点低 | |
| C. | X的气态氢化物比Y的气态氢化物稳定 | |
| D. | Y的单质能将X从H2X的溶液中置换出来 |
7.据报道:1994年11月9日德国科学家利用数亿镍原子(28Ni)对数亿个铅原子(82Pb)连续轰击数天后,制得一种新原子269X(暂用X表示),它属于一种新元素--第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒.则该X元素原子核内的中子数是( )
| A. | 269 | B. | 110 | C. | 159 | D. | 82 |
4.从实验室用氯酸钾制取氧气后的剩余物中回收二氧化锰的操作顺序正确的是(已知MnO2为黑色难溶于水的固体)( )
| A. | 溶解、蒸发、洗涤、过滤 | B. | 溶解、过滤、蒸发、洗涤 | ||
| C. | 溶解、过滤、洗涤、干燥 | D. | 溶解、洗涤、过滤、加热 |
8.下列化学用语正确的是( )
| A. | S2-的结构示意图 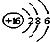 | B. | 中子数为16的硫原子:${\;}_{16}^{34}$S | ||
| C. | 羟基的电子式: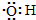 | D. | 乙烯的分子式:CH2=CH2 |
5.分类是学习和研究化学的一种重要方法,下列分类合理的是( )
| A. | Na2CO3和K2O都属于盐 | B. | Na2O和Na2SiO3都属于氧化物 | ||
| C. | KOH和Na2CO3都属于碱 | D. | H2SO4和HNO3都属于酸 |
 ;煤的另一种化工方法是将煤在高温条件下与水蒸气反应制造水煤气,写出该反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
;煤的另一种化工方法是将煤在高温条件下与水蒸气反应制造水煤气,写出该反应的化学方程式C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.