题目内容
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如下反应。(图中有些反应的产物和反应条件没有标出)
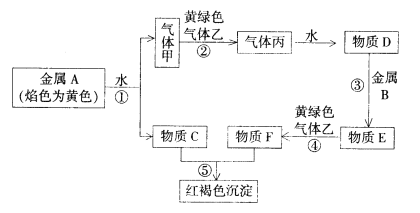
请回答下列问题:
(1)A的化学式为_____________,丙的化学式为_____________;
(2)写出下列反应的离子方程式:
① _________________________________________;
④ _________________________________________;
⑤ _________________________________________。
(3)写出C溶液与Al反应的化学方程式:____________________。
(4)将过氧化钠投入到E溶液中,可以观察到的现象是:_____________。
【答案】NaHCl2Na+2H2O=2Na++2OH-+H2↑2Fe2++Cl2=2Fe3++2Cl-Fe3++2OH-=Fe(OH)3↓2Al+2NaOH+2H2O=2NaAlO2+3H2↑生成红褐色沉淀;有无色气体产生
【解析】
金属A焰色反应为黄色,故A为Na,由反应①Na+水→气体甲+C,则甲为H2,C为NaOH,黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质D为盐酸。氢氧化钠与物质F反应生成红褐色沉淀是Fe(OH)3,故物质F中含有Fe3+,盐酸与金属B反应得到E,E与氯气反应得到F,可知金属B为Fe,物质E为FeCl2,物质F为FeCl3。
(1)金属单质A的焰色反应为黄色,因此A为Na,黄绿色气体乙为Cl2,则丙为HCl。(2)反应①为金属A为钠和水反应生成氢氧化钠和氢气,反应的离子方程式:2Na+2H2O=
2Na++2OH-+H2↑;反应④为氯化亚铁被氯气氧化为氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;反应⑤为氯化铁溶液与氢氧化钠反应生成氢氧化铁沉淀和氯化钠,反应的离子方程式为:Fe3++2OH-=Fe(OH)3↓。(3)NaOH溶液与Al反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑。(4)将过氧化钠投入到到FeCl2溶液中,过氧化钠具有强氧化性,且与水反应生成氢氧化钠与氧气,可以观察到的现象是:有气体生成,有红褐色沉淀生成。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻松振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别是()
a(干燥气体) | b(液体) | |
A | NO | 水 |
B | CO2 | 4molL-1NaOH溶液 |
C | Cl2 | 饱和NaCl溶液 |
D | NH3 | 1molL-1盐酸 |
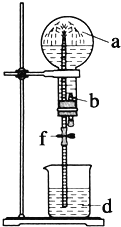
A. A B. B C. C D. D



