题目内容
下列离子检验的结论可靠的是 ( )
A.用干燥洁净的铂丝蘸取溶液,在火焰上灼烧,若火焰呈黄色,证明不含K+
B.向溶液中加入新制氯水和CCl4,振荡、静置,若上层溶液呈紫红色,证明含有I—
C.向溶液中先加入新制氯水,再加入KSCN溶液,若溶液呈血红色,证明含有Fe2+
D.向溶液中加入氢氧化钠溶液,若立即产生红褐色沉淀,证明含有Fe3+
【答案】
B
【解析】

练习册系列答案
相关题目
电子产品产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
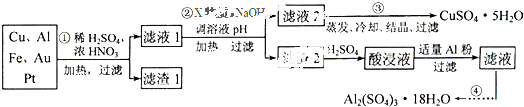
按要求回答下列问题:
(1)滤渣1中存在的金属有 .
(2)已知沉淀物的pH如下表:
①则操作②中X物质最好选用的是 (填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是 .
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是 .
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应: .
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在 (填仪器名称)中加热脱水.
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是 (填序号)
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
>
D.
<
.

按要求回答下列问题:
(1)滤渣1中存在的金属有
(2)已知沉淀物的pH如下表:
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是
(4)用一个离子方程式表示在酸浸液中加入足量铝粉的反应:
(5)由CuSO4?5H2O制备CuSO4时,应把CuSO4?5H2O放在
(6)现向一含有Ca2+、Cu2+的混合溶液中滴加Na2CO3溶液,若首先生成CuCO3沉淀,根据该实验可得出的结论是
A.Ksp(CuCO3)<Ksp(CaCO3) B.c(Cu2+)<c(Ca2+)
C.
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |
| c(Cu2+) |
| c(Ca2+) |
| Ksp(CuCO3) |
| Ksp(CaCO3) |