题目内容
下列实验能够达到预期目的是( )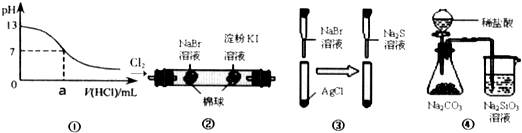

| A、①可用于表示:0.1mol?L-1的NaOH溶液滴定盐酸的滴定曲线 | B、②可用于证明;氧化性:Cl2>Br2>I2 | C、③可用于证明:Ksp(AgCl)>Kxp(AgBr)>Ksp(Ag2S) | D、④可用于证明:非金属性:Cl>C>Si |
分析:A、图示①应该为盐酸滴定0.1mol?L-1的氢氧化钠溶液的滴定曲线;
B、②只能证明氯气的氧化性大于溴单质的氧化性,无法证明溴蒸气氧化性强于碘单质;
C、根据③中沉淀颜色变化判断沉淀的转化情况,然后根据溶解度越小,溶解度越大比较溶度积大小;
D、由于盐酸具有挥发性,无法证明碳酸的酸性强于硅酸酸性.
B、②只能证明氯气的氧化性大于溴单质的氧化性,无法证明溴蒸气氧化性强于碘单质;
C、根据③中沉淀颜色变化判断沉淀的转化情况,然后根据溶解度越小,溶解度越大比较溶度积大小;
D、由于盐酸具有挥发性,无法证明碳酸的酸性强于硅酸酸性.
解答:解:A、0.1mol?L-1的NaOH溶液滴定盐酸的滴定曲线,横坐标应该为加入的氢氧化钠溶液的体积,图示①应该为盐酸滴定0.1mol?L-1的NaOH溶液的滴定曲线,故A错误;
B、由于氯气与溴化钠反应生成的溴单质为液体,无法证明溴单质的氧化性大于碘单质的氧化性,故B错误;
C、③中氯化银为白色沉淀,加入溴化钠后,白色沉淀变成浅黄色溴化银沉淀,证明溶解度:AgCl)>AgBr,所以Ksp(AgCl)>Ksp(AgBr);将硫化钠加入溴化银沉淀中,沉淀转化成黑色沉淀,证明Ksp(AgBr)>Ksp(Ag2S),所以Ksp(AgCl)>Ksp(AgBr)>Ksp(Ag2S),故C正确;
D、④中由于生成的二氧化碳中含有氯化氢,无法证明碳酸的酸性强于硅酸酸性,也就无法证明非金属性:Cl>C>Si,故D错误;
故选C.
B、由于氯气与溴化钠反应生成的溴单质为液体,无法证明溴单质的氧化性大于碘单质的氧化性,故B错误;
C、③中氯化银为白色沉淀,加入溴化钠后,白色沉淀变成浅黄色溴化银沉淀,证明溶解度:AgCl)>AgBr,所以Ksp(AgCl)>Ksp(AgBr);将硫化钠加入溴化银沉淀中,沉淀转化成黑色沉淀,证明Ksp(AgBr)>Ksp(Ag2S),所以Ksp(AgCl)>Ksp(AgBr)>Ksp(Ag2S),故C正确;
D、④中由于生成的二氧化碳中含有氯化氢,无法证明碳酸的酸性强于硅酸酸性,也就无法证明非金属性:Cl>C>Si,故D错误;
故选C.
点评:本题考查了中和滴定、难溶电解质的溶解平衡及沉淀转化的本质、卤素单质非金属性强弱比较等知识,题目难度中等,涉及的知识点较多,充分考查了学生对所学知识的掌握情况及灵活应用情况,培养了学生的分析、理解能力.

练习册系列答案
相关题目