题目内容
下列说法正确的是
| A.14C与14N互为同位素 | B.葡萄糖与果糖互为同分异构体 |
| C.H2与CH4互为同系物 | D.SO2与SO3互为同素异形体 |
B
解析试题分析:B.葡萄糖与果糖分子式相同,结构不同,互为同分异构体。
考点:几组概念的辨析

练习册系列答案
相关题目
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
| A.离子半径:X+ >Y- |
| B.Z元素的最高正化合价与最低负化合价代数和为4 |
| C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 |
| D.Y的氢化物中存在离子键 |
元素周期律和元素周期表是学习化学的重要工具,下列叙述不正确的是( )
| A.从左到右,元素周期表中的第13列为ⅢA族 |
| B.某ⅡA族元素的原子序数为x ,则与它同周期的ⅢA族元素的原子序数可能为x+25 |
| C.ⅥA族元素,随原子半径增大,对应气态氢化物的稳定性逐渐增强 |
| D.53号元素位于周期表P区、第五周期ⅦA族。 |
下列有关元素及其化合物性质的比较正确的是
| A.原子半径:F<O<Al | B.稳定性:H2O<PH3<NH3 |
| C.酸性:H2CO3<H2SO4<H3PO4 | D.碱性:LiOH<NaOH<Al(OH)3 |
元素的原子半径在周期表中呈现周期性变化的根本原因是( )。
| A.原子的相对原子质量呈现周期性变化 |
| B.元素的化合价呈现周期性变化 |
| C.原子的性质呈现周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |
生活中的下列现象与原子核外电子发生跃迁有关的是( )。
| A.钢铁长期使用后生锈 |
| B.节日里燃放的焰火 |
| C.金属导线可以导电 |
| D.卫生丸久置后消失 |
对于原子核外电子以及电子的运动,下列描述正确的是( )。
①可以测定某一时刻电子所处的位置
②电子质量很小且带负电荷
③运动的空间范围很小
④高速运动
⑤有固定的运动轨道
⑥电子的质量约为质子质量的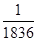
| A.①②③ | B.②③④⑥ | C.③④⑤⑥ | D.⑤⑥ |
关于原子模型的演变过程,正确的是( )。
| A.汤姆逊原子模型→道尔顿原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
| B.汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型→道尔顿原子模型 |
| C.道尔顿原子模型→卢瑟福原子模型→汤姆逊原子模型→玻尔原子模型→量子力学模型 |
| D.道尔顿原子模型→汤姆逊原子模型→卢瑟福原子模型→玻尔原子模型→量子力学模型 |
下列说法中正确的是( )。
| A.在周期表中金属与非金属的分界处可以找半导体材料 |
| B.H2S、H2Se、HF的热稳定性依次增强 |
| C.NaOH、KOH、Mg(OH)2的碱性依次减弱 |
| D.Cl、S、N元素的非金属性依次增强 |