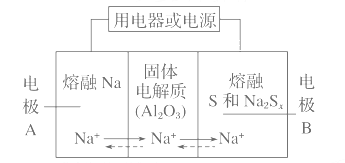
题目内容
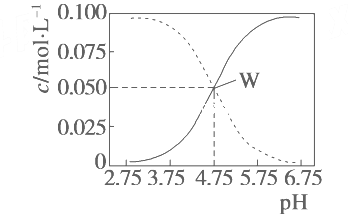
【题目】25 ℃,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关叙述正确的是( )
A. pH=5.5溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. W点表示溶液中:2c(Na+)=c(CH3COO-) +c(CH3COOH)
C. pH=3.75溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D. 只根据图中数据,无法计算出25 ℃时醋酸的电离平衡常数
【答案】A
【解析】A.pH=5.5溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W点时c(CH3COOH)=c(CH3COO-),而氢离子浓度较小,则c(H+)<<c(Na+)+c(H+)、c(H+)<<c(CH3COOH),c(Na+)+c(H+)<c(CH3COO-)+c(CH3COOH),2c(Na+)≠c(CH3COO-) +c(CH3COOH),故B错误;C.由图可知,pH=3.75的溶液,显酸性,且存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则此时c(CH3COO-)>c(Na+),故C错误;D.根据图中数据,W点c(CH3COOH)=c(CH3COO-),平衡常数K=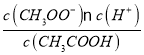 =10-4.75molL-1,故D错误;答案为A。
=10-4.75molL-1,故D错误;答案为A。

【题目】已知酸性条件下有以下反应关系: ①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。②Br2能将I-氧化为I2。③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2。现向含有1 mol KI的硫酸溶液中加入含amol KBrO3的溶液,a的取值不同,所得产物也不同。下列判断正确的是:
编号 | a的取值范围 | 产物的化学式 |
① | a≤1/6 | I2、Br- |
② | 1/6<a<1/5 | I2、Br-、Br2 |
③ | 1/5<a<6/5 | I2、IO3-、Br2 |
④ | a≥6/5 | IO3-、Br2 |
A. ①③④ B. ②③④ C. ①②③④ D. ①④