题目内容
【题目】【化学—选修3:物质结构与性质】
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为 。
(2)锗、砷、硒的第一电离能大小排序为 。H2SeO4的酸性比H2SeO3的强,其原因是 。
(3)H2SeO3的中心原子杂化类型是 ;SeO32- 的立体构型是 。与SeO32- 互为等电体的分子有(写一种物质的化学式即可) 。
(4)H2Se属于 (填“极性”或“非极性”)分子;单质硒的熔点为217℃,它属于 晶体。
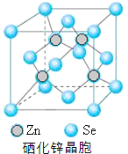
(5)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为 ;若该晶胞密度为ρgcm-3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为 pm。
【答案】(1)4s24p4 (1分)(2)As>Se>Ge(2分);
H2SeO4分了中非羟基氧数大于H2SeO3(2分)
(3)sp3;三角锥形;PCl3(或C4H10等)(4)极性;分子
(5)4(1分);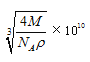 (3分)
(3分)
【解析】
试题分析:(1)硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,所以Ge、As、Se三种元素的第一电离能的大小顺序是:As>Se>Ge;由于H2SeO4分子中非羟基氧原子个数大于H2SeO3,所以H2SeO4的酸性比H2SeO3的强;
(3)H2SeO3的中心原子的价层电子对数为![]() ×(6+2)=4,所以Se杂化方式为sp3杂化,SeO32-的中心原子Se的价层电子对数为
×(6+2)=4,所以Se杂化方式为sp3杂化,SeO32-的中心原子Se的价层电子对数为![]() ×(6+2)=4,离子中有一个孤电子对,所以SeO32-的立体构型是三角锥形,等电子体是指价电子和原子数都相等的微粒,与SeO32-互为等电体的分子有 PCl3(或C4H10等);
×(6+2)=4,离子中有一个孤电子对,所以SeO32-的立体构型是三角锥形,等电子体是指价电子和原子数都相等的微粒,与SeO32-互为等电体的分子有 PCl3(或C4H10等);
(4)H2Se分子中有孤电子对,所以H2Se属于 极性分子,单质硒的熔点为217℃,比较小,所以它属于分子晶体;
(5)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为8×![]() +6×
+6×![]() =4,含有锌原子数为4,根据ρ=
=4,含有锌原子数为4,根据ρ=![]() =
=![]() ,所以V=
,所以V=![]() ,则晶胞的边长为
,则晶胞的边长为![]() cm=
cm=![]() ×1010pm。
×1010pm。

【题目】用下图所示装置进行下列实验,实验结果与预测的现象不一致的是
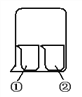
① 中的物质 | ② 中的物质 | 预测①中的现象 | |
A | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
B | 酚酞溶液 | 浓盐酸 | 无明显变化 |
C | AlCl3溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D