题目内容
【题目】(1)按如图所示操作,充分反应后:
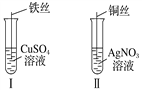
①Ⅰ中铁丝上观察到的现象是______________________;
②Ⅱ中发生反应的离子方程式为_______________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_____________。
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热。
①写出制备氢氧化铁胶体的化学方程式____________________.
②向氢氧化铁胶体中逐滴滴入过量盐酸,出现的实验现象为:___________________________
【答案】 铁丝上析出了红色固体 Cu + 2Ag+= 2Ag + Cu2+ Ag+> Cu2+>Fe2+ FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl 先出现红褐色沉淀,之后沉淀又逐渐溶解
Fe(OH)3(胶体)+3HCl 先出现红褐色沉淀,之后沉淀又逐渐溶解
【解析】试题分析:本题考查离子方程式的书写,氧化性强弱的比较,氢氧化铁胶体的制备和性质。
(1)①Fe丝插入CuSO4溶液中,发生置换反应:Fe+CuSO4=FeSO4+Cu,反应的离子方程式为:Fe+Cu2+=Fe2++Cu,铁丝上观察到的现象是:铁丝上析出红色固体。
②铜丝插入AgNO3溶液中,发生置换反应:Cu+2AgNO3=Cu(NO3)2+2Ag,反应的离子方程式为:Cu+2Ag+=Cu2++2Ag。
③根据同一个氧化还原反应中,氧化性:氧化剂![]() 氧化产物。由反应Fe+Cu2+=Fe2++Cu得出氧化性:Cu2+
氧化产物。由反应Fe+Cu2+=Fe2++Cu得出氧化性:Cu2+![]() Fe2+;由反应Cu+2Ag+=Cu2++2Ag得出氧化性:Ag+
Fe2+;由反应Cu+2Ag+=Cu2++2Ag得出氧化性:Ag+![]() Cu2+,则Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为Ag+
Cu2+,则Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为Ag+![]() Cu2+
Cu2+![]() Fe2+。
Fe2+。
(2)①制备氢氧化铁胶体的化学方程式为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
②盐酸属于电解质溶液,在氢氧化铁胶体中加入盐酸,盐酸使氢氧化铁胶体发生聚沉,观察到产生红褐色沉淀,继续加盐酸,发生反应Fe(OH)3+3HCl=FeCl3+3H2O,沉淀逐渐溶解。所以向氢氧化铁胶体中逐滴滴入过量盐酸,出现的实验现象是:先出现红褐色沉淀,之后沉淀又逐渐溶解。