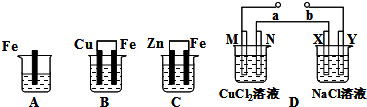
��Ŀ����
A��B��C�����ձ��зֱ�ʢ����ͬ���ʵ���Ũ�ȵ�����ͭ��Һ��DΪ���أ����е缫���Ͼ�Ϊ�������ʣ�ͨ��������ֱ����Դ������ʵ�鿪ʼʱ��ͬʱ��XY���߸����뼸�η�̪��Һ��X���������ȱ�죮

��ش��������⣺
��1��B��Cu���缫��ӦʽΪ
��2��A��B��C�����ձ���Fe�ķ�Ӧ����������
��3����C�б���ʴ������������32.5g����Ӧ��ת�Ƶĵ��ӵ����ʵ�����
��4��D��ֱ����ԴaΪ
��5�����D��N���ϵĵ缫��ӦʽΪ��
��6��D����M��N��X��Y���缫����������������ʵ���֮��Ϊ

��ش��������⣺
��1��B��Cu���缫��ӦʽΪ
Cu2++2e-=Cu
Cu2++2e-=Cu
����2��A��B��C�����ձ���Fe�ķ�Ӧ����������
B
B
����3����C�б���ʴ������������32.5g����Ӧ��ת�Ƶĵ��ӵ����ʵ�����
1mol
1mol
����4��D��ֱ����ԴaΪ
��
��
������5�����D��N���ϵĵ缫��ӦʽΪ��
2Cl--2e-=Cl2��
2Cl--2e-=Cl2��
����6��D����M��N��X��Y���缫����������������ʵ���֮��Ϊ
1��1��1��1
1��1��1��1
����������1��ԭ�����ʧ���ӵļ��Ǹ����õ��ӵļ���������
��2�������ĸ�ʴ���ʣ�ԭ��صĸ�����ʴ���ʣ���ѧ��ʴ��ԭ��ص�������ʴ���ʣ�
��3�����ݵ缫��Ӧʽ������ת�Ƶ��Ӻ����Ľ������Ĺ�ϵ��
��4�������к͵�Դ�ĸ������������������͵�Դ��������������������
��5�����ص����������ڻ��õ缫ʱ��������е��������ڸü�����ʧ���ӵ�������Ӧ��
��6��������·��ת�Ƶĵ���������ȵģ����ݵ���ת�ƵĶ�����������������������ʵ�����
��2�������ĸ�ʴ���ʣ�ԭ��صĸ�����ʴ���ʣ���ѧ��ʴ��ԭ��ص�������ʴ���ʣ�
��3�����ݵ缫��Ӧʽ������ת�Ƶ��Ӻ����Ľ������Ĺ�ϵ��
��4�������к͵�Դ�ĸ������������������͵�Դ��������������������
��5�����ص����������ڻ��õ缫ʱ��������е��������ڸü�����ʧ���ӵ�������Ӧ��
��6��������·��ת�Ƶĵ���������ȵģ����ݵ���ת�ƵĶ�����������������������ʵ�����
����⣺A�ǽ�����ֱ�Ӻ�����֮ͭ��ķ�Ӧ��B��ԭ��أ�������Ϊ����������ͭΪ������CΪԭ��أ�����п�Ǹ�������������������D����XY���߸����뼸�η�̪��Һ��X���������ȱ�죬˵��X�����������ӷŵ��ˣ�����X��������������Y����������b���ǵ�Դ��������a���ǵ�Դ�ĸ�����M����������N��������
��1��B��Cu��Ϊ����������ͭ���ӵõ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪCu2++2e-=Cu���ʴ�Ϊ��Cu2++2e-=Cu��
��2�������ĸ�ʴ���ʣ�ԭ��صĸ�����ʴ���ʣ���ѧ��ʴ��ԭ��ص�������ʴ���ʣ�����Ӧ����������B���ʴ�Ϊ��B��
��3��C�и�����Ӧ�ǣ�Zn-2e-��Zn2+������ʴ����п��������32.5g��0.5molʱ��ת�Ƶ�������1mol���ʴ�Ϊ��1mol��
��4��M����������a���ǵ�Դ�ĸ������ʴ�Ϊ������
��5�����D��N���������������ӷ���ʧ���ӵ�������Ӧ���缫��ӦʽΪ��2Cl--2e-=Cl2�����ʴ�Ϊ��2Cl--2e-=Cl2����
��6��D����M��N��X��Y���缫�ϵĵ缫��Ӧ�ֱ�Ϊ��M��Cu2++2e-��Cu��N��2Cl-��Cl2��+2e-��X��2Cl-��Cl2��+2e-��Y��2H++2e-��H2������ת�Ƶ��ӵ����ʵ������ʱ������������ʵ���Ҳ��ȣ���������������ʵ���֮��Ϊ1��1��1��1���ʴ�Ϊ��1��1��1��1��
��1��B��Cu��Ϊ����������ͭ���ӵõ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪCu2++2e-=Cu���ʴ�Ϊ��Cu2++2e-=Cu��
��2�������ĸ�ʴ���ʣ�ԭ��صĸ�����ʴ���ʣ���ѧ��ʴ��ԭ��ص�������ʴ���ʣ�����Ӧ����������B���ʴ�Ϊ��B��
��3��C�и�����Ӧ�ǣ�Zn-2e-��Zn2+������ʴ����п��������32.5g��0.5molʱ��ת�Ƶ�������1mol���ʴ�Ϊ��1mol��
��4��M����������a���ǵ�Դ�ĸ������ʴ�Ϊ������
��5�����D��N���������������ӷ���ʧ���ӵ�������Ӧ���缫��ӦʽΪ��2Cl--2e-=Cl2�����ʴ�Ϊ��2Cl--2e-=Cl2����
��6��D����M��N��X��Y���缫�ϵĵ缫��Ӧ�ֱ�Ϊ��M��Cu2++2e-��Cu��N��2Cl-��Cl2��+2e-��X��2Cl-��Cl2��+2e-��Y��2H++2e-��H2������ת�Ƶ��ӵ����ʵ������ʱ������������ʵ���Ҳ��ȣ���������������ʵ���֮��Ϊ1��1��1��1���ʴ�Ϊ��1��1��1��1��
���������⿼��ѧ���绯ѧ��ԭ��غ͵��صĹ���ԭ��֪ʶ�����Ը�����ѧ֪ʶ���лش��ѶȲ���

��ϰ��ϵ�д�
 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
�����Ŀ
|
Ũ����ͬ��NaOH��Һ��100 ml����A��B��C�����ձ��У��ֱ���������Һ��ͨ�벻������CO2����ַ�Ӧ����������������Һ����μ���0.2 mol/L�����ᣬ����CO2������������������֮���ϵ����ͼ��ʾ�������ж���ȷ����
| |
A�� |
ԭNaOH��Һ��Ũ��Ϊ0.2 mol/L |
B�� |
B�ձ���ͨ���CO2���Ϊ448 mL |
C�� |
ͨ��CO2����ȷ��A�ձ��е����� |
D�� |
ͨ��CO2��C�ձ������ʳɷֵ����ʵ���֮��Ϊ n(NaOH)��n(Na2CO3)��2��1 |