题目内容
【题目】下列说法正确的是
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
⑤向一定量的Cu、Fe2O3的混合物中加入300 mL 1mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含有Fe3+。若用过量的CO在高温下还原相同质量的此混合物,固体减少的质量为2.4g
⑥磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=== Fe3++NO↑+3H2O
⑦氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑧Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应制取Fe(OH)3
⑨赤铁矿的主要成分是Fe3O4,Fe3O4为红棕色晶体
⑩下图所示装置能较长时间观察到Fe(OH)2白色沉淀

A. ①④⑦ B. ⑤⑧ C. ②③⑩ D. ⑤⑥⑨
【答案】B
【解析】①NO3-在酸性条件下具有强氧化性,能把Fe2+氧化成Fe3+,溶液的颜色由浅绿色转变成棕黄色,FeO加入到稀硫酸中发生FeO+H2SO4=FeSO4+H2O,溶液为浅绿色,故①错误;②样品中加入盐酸中,取上层清液,然后加入KSCN溶液,溶液变红,说明含有Fe3+,即红砖中含有氧化铁,故②错误;③FeCl3溶液中得到无水FeCl3,需要在氯化氢的氛围中加热,防止Fe3+水解,最终生成Fe2O3,故③错误;④氢氧化亚铁容易被氧气氧化成氢氧化铁,白色沉淀转变成红褐色沉淀,故④错误;⑤发生的反应是:Fe2O3+6HCl=2FeCl3+3H2O,Cu+2FeCl3=CuCl2+2FeCl2,用过量的CO在高温下还原相同质量相同的混合物,固体质量减少的质量应是混合物中的氧元素,根据反应方程式,混合物中氧元素转化成水,因此混合物中氧的质量为300×10-3×1×16/2g=2.4g,即固体减少的质量为2.4g,故⑤正确;⑥磁性氧化铁是Fe3O4,属于氧化物,书写离子反应方程式时,不能拆写成离子形式,故⑥错误;⑦Fe3+的氧化性强于I2,因此Fe3+把I-氧化成I2,故⑦错误;⑧Fe2O3是难溶于水的氧化物,不与水反应生成Fe(OH)3,但可以通过4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,故⑧正确;⑨赤铁矿是Fe2O3,故⑨错误;⑩氢氧化亚铁容易被氧气氧化成氢氧化铁,此装置没有作防止氧气进入装置的防护,因此此装置不能长时间观察到氢氧化亚铁的白色沉淀,故⑩错误;综上所述,选项B正确。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
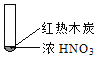
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应