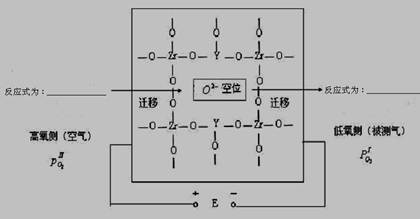
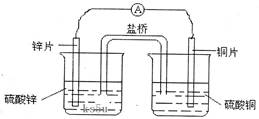
题目内容
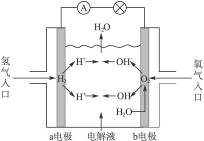
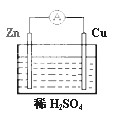
宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,试写出电解质溶液为盐酸时的电极反应式
,并指出各电极和介质溶液的pH的变化,若电解质溶液为KOH时又如何?
,并指出各电极和介质溶液的pH的变化,若电解质溶液为KOH时又如何?
若电解质为盐酸时:
负极:2H2-4e—=4H+ pH变小
正极:O2+4H++4e—=2H2O pH变大
结论:溶液被稀释,pH变大。
若电解质为KOH时:
负极:2H2-4e—+4OH-=4H2O pH变小
正极:O2+2H2O+4e=4OH- pH变大
结论:溶液被稀释,pH变小。
负极:2H2-4e—=4H+ pH变小
正极:O2+4H++4e—=2H2O pH变大
结论:溶液被稀释,pH变大。
若电解质为KOH时:
负极:2H2-4e—+4OH-=4H2O pH变小
正极:O2+2H2O+4e=4OH- pH变大
结论:溶液被稀释,pH变小。
在负极氢气失去电子,发生氧化反应;在正极氧气得到电子,发生还原反应。若消耗H+,则pH增大;若消耗OH-,则pH减小;若生成OH-,则pH增大;若生成H+,则pH减小。若稀释酸溶液,则pH增大;若稀释碱溶液,则pH减小。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
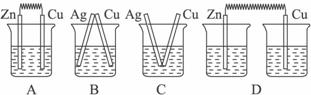
下列说法中正确的是( )
| A.镍氢电池、锂离子电池和锌锰干电池都是二次电池 |
| B.燃料电池是一种高效且不会污染环境的新型电池 |
| C.化学电池的反应基础是复分解反应 |
| D.铅蓄电池放电的时候正极是Pb,负极是PbO2 |