题目内容
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲:
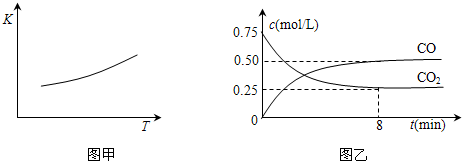
(1)该反应的平衡常数表达式K= .
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示.
8分钟内,CO的平均反应速率v(CO)= mol/(L?min).
(3)下列措施中能使平衡时c(CO)/c(CO2)增大的是 (填序号).
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
(4)铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点.
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 .
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化纳和水,该反应的离子方程式为 .
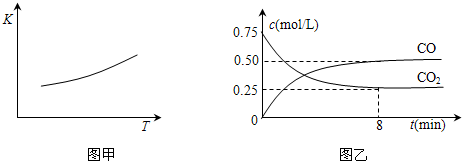
(1)该反应的平衡常数表达式K=
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图乙所示.
8分钟内,CO的平均反应速率v(CO)=
(3)下列措施中能使平衡时c(CO)/c(CO2)增大的是
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
(4)铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点.
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
| 电解 |
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化纳和水,该反应的离子方程式为
分析:(1)根据反应Fe(s)+CO2(g)?FeO(s)+CO(g)中各物质状态及平衡常数表达式写出该反应的平衡常数表达式K;
(2)根据v=
计算8分钟内,CO的平均反应速率v(CO);
(3)根据反应前后气体的计量数之和关系以及压强对平衡移动的影响分析;
(4)①阳极发生氧化反应,根据反应物和生成物书写电极反应式;
②根据氧化还原反应中电荷守恒、电子转移守恒、原子守恒可知另外的化合物含有H元素,应为水,据此写出离子方程式.
(2)根据v=
| △c |
| △t |
(3)根据反应前后气体的计量数之和关系以及压强对平衡移动的影响分析;
(4)①阳极发生氧化反应,根据反应物和生成物书写电极反应式;
②根据氧化还原反应中电荷守恒、电子转移守恒、原子守恒可知另外的化合物含有H元素,应为水,据此写出离子方程式.
解答:解:(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)中,铁和氧化亚铁为固体,不影响平衡的移动,所以该反应的平衡常数表达式为K=
,
故答案为:
;
(2)根据图乙可知,8分钟内一氧化碳的浓度变化为0.5mol/L,所以CO的平均反应速率v(CO)=
=0.0625mol/(L?min),
故答案为:0.0625;
(3)A.该反应正反应为吸热反应,升高温度,平衡向正反应进行,c(CO)增大c(CO2)减小,所以 c(CO)/c(CO2)的值增大,故A正确;
B.该反应反应前后气体的体积不变,增大压强平衡不移动,c(CO)/c(CO2)的值不变,故B错误;
C.恒温恒容,充入一定量氮气,c(CO)、c(CO2)不变,平衡不移动,c(CO)/c(CO2)的值不变,故C错误;
D.铁粉为固体,浓度为定值,增加铁粉的用量,不影响平衡,c(CO)/c(CO2)的值不变,故D错误;
故答案为:A;
(4)①电解时Fe作阳极,失去电子生成FeO42-,则电极反应式应为Fe+8OH--6e-=FeO42-+4H2O,故答案为:Fe+8OH--6e-=FeO42-+4H2O;
②强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,根据电荷守恒、电子转移守恒、原子守恒可知另一种常见化合物含有H元素,应为水,离子方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.
| c(CO) |
| c(CO2) |
故答案为:
| c(CO) |
| c(CO2) |
(2)根据图乙可知,8分钟内一氧化碳的浓度变化为0.5mol/L,所以CO的平均反应速率v(CO)=
| 0.5mol/L |
| 8min |
故答案为:0.0625;
(3)A.该反应正反应为吸热反应,升高温度,平衡向正反应进行,c(CO)增大c(CO2)减小,所以 c(CO)/c(CO2)的值增大,故A正确;
B.该反应反应前后气体的体积不变,增大压强平衡不移动,c(CO)/c(CO2)的值不变,故B错误;
C.恒温恒容,充入一定量氮气,c(CO)、c(CO2)不变,平衡不移动,c(CO)/c(CO2)的值不变,故C错误;
D.铁粉为固体,浓度为定值,增加铁粉的用量,不影响平衡,c(CO)/c(CO2)的值不变,故D错误;
故答案为:A;
(4)①电解时Fe作阳极,失去电子生成FeO42-,则电极反应式应为Fe+8OH--6e-=FeO42-+4H2O,故答案为:Fe+8OH--6e-=FeO42-+4H2O;
②强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,根据电荷守恒、电子转移守恒、原子守恒可知另一种常见化合物含有H元素,应为水,离子方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.
点评:本题综合性较大,涉及反应速率、平衡影响因素、氧化还原反应、读图提取信息等,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
 Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
Ⅰ.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0 (2011?福建模拟)一定条件下铁可以和CO2发生反应:
(2011?福建模拟)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0 (2012?长宁区二模)铁是一种重要的金属,它的单质及化合物有着各自的性质.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图所示:
(2012?长宁区二模)铁是一种重要的金属,它的单质及化合物有着各自的性质.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图所示: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0