题目内容
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去).试回答:

(1)若A是乙醇,则C的结构简式是______,反应①的化学方程式______;2001年5月,中国宣布将推广“车用乙醇汽油”,所谓乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料.下列叙述中一定错误的是______.
A.乙醇汽油是一种新型的化合物
B.汽车使用乙醇汽油能减少有害气体的排放
C.工业常用裂化的方法提高汽油的产量
D.用玉米、高粱发酵可以制得乙醇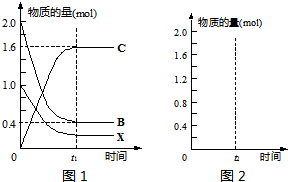
(2)若A是一种工业制硫酸的含金属元素矿物质主要成分,则A的化学式为______,反应②的化学方程式______.某温度T时,在一定条件的2L密闭容器中,反应②从起始到平衡后的关系如图1所示.请据图回答下列问题:
①物质B的转化率______.
②求该温度下反应②的平衡常数______.
③在上述相同条件下,向相同的容器中投入2mol C,t2时刻达到平衡.请在图2中画出从反应开始至平衡后各物质物质的量与时间的关系图______.
解:(1)乙醇能够被氧化为乙醛,然后乙醛可继续被氧化为乙酸,则C为乙酸,其结构简式为CH3COOH,反应①的化学方程式为2CH3CH2OH+O2 2CH3CHO+2H2O;乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料,所以乙醇汽油属于混合物,该汽油中物质含有C、H、O元素,汽车使用乙醇汽油能减少有害气体的排放,工业常用裂化的方法提高汽油的产量,用玉米、高粱(主要成分为淀粉)发酵可以制得乙醇,即只有A是一定错误的;
2CH3CHO+2H2O;乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料,所以乙醇汽油属于混合物,该汽油中物质含有C、H、O元素,汽车使用乙醇汽油能减少有害气体的排放,工业常用裂化的方法提高汽油的产量,用玉米、高粱(主要成分为淀粉)发酵可以制得乙醇,即只有A是一定错误的;
故答案为:CH3COOH;2CH3CH2OH+O2 2CH3CHO+2H2O;A;
2CH3CHO+2H2O;A;
(2)A是一种工业制硫酸的含金属元素矿物质主要成分,则A为FeS2,FeS2能燃烧生成SO2,SO2催化氧化生成SO3,反应②的化学方程式为2SO2+O2 2SO3,
2SO3,
故答案为:FeS2;2SO2+O2 2SO3;
2SO3;
①由图1可知,参加反应的B的物质的量为1.6mol,则B的转化率为 ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
②由图1可知,平衡时,CB=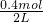 =0.2mol/L,CX=
=0.2mol/L,CX= =0.1mol/L,CC=
=0.1mol/L,CC= =0.8mol/L,所以K=
=0.8mol/L,所以K= =160,故答案为:160;
=160,故答案为:160;
③相同条件下,相同的容器中投入2mol C,二者为等效平衡,即达到平衡时与上述平衡中各物质的浓度相同,平衡时X的物质的量为0.2mol,B的物质的量为0.4mol,C的物质的量为1.6mol,如图所示,

故答案为:
分析:(1)乙醇能够被氧化为乙醛,然后乙醛可继续被氧化为乙酸;乙醇汽油属于混合物;
(2)A是一种工业制硫酸的含金属元素矿物质主要成分,则A为FeS2,FeS2能燃烧生成SO2,SO2催化氧化生成SO3;
①由图可知,参加反应的B的物质的量为1.6mol,以此计算转化率;
②根据平衡时各物质的浓度及K的定义式来计算;
③相同条件下,相同的容器中投入2mol C,二者为等效平衡,即达到平衡时与上述平衡中各物质的浓度相同,以此来作图.
点评:本题考查无机物的推断及化学平衡的计算,明确乙醇的性质及工业制硫酸的反应、化学平衡常数、转化率的计算即可解答,注意等效平衡的应用来解答最后一问,题目难度不大.
 2CH3CHO+2H2O;乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料,所以乙醇汽油属于混合物,该汽油中物质含有C、H、O元素,汽车使用乙醇汽油能减少有害气体的排放,工业常用裂化的方法提高汽油的产量,用玉米、高粱(主要成分为淀粉)发酵可以制得乙醇,即只有A是一定错误的;
2CH3CHO+2H2O;乙醇汽油就是在无铅汽油里加入适量乙醇混合而成的一种燃料,所以乙醇汽油属于混合物,该汽油中物质含有C、H、O元素,汽车使用乙醇汽油能减少有害气体的排放,工业常用裂化的方法提高汽油的产量,用玉米、高粱(主要成分为淀粉)发酵可以制得乙醇,即只有A是一定错误的;故答案为:CH3COOH;2CH3CH2OH+O2
 2CH3CHO+2H2O;A;
2CH3CHO+2H2O;A;(2)A是一种工业制硫酸的含金属元素矿物质主要成分,则A为FeS2,FeS2能燃烧生成SO2,SO2催化氧化生成SO3,反应②的化学方程式为2SO2+O2
 2SO3,
2SO3,故答案为:FeS2;2SO2+O2
 2SO3;
2SO3;①由图1可知,参加反应的B的物质的量为1.6mol,则B的转化率为
 ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;②由图1可知,平衡时,CB=
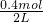 =0.2mol/L,CX=
=0.2mol/L,CX= =0.1mol/L,CC=
=0.1mol/L,CC= =0.8mol/L,所以K=
=0.8mol/L,所以K= =160,故答案为:160;
=160,故答案为:160;③相同条件下,相同的容器中投入2mol C,二者为等效平衡,即达到平衡时与上述平衡中各物质的浓度相同,平衡时X的物质的量为0.2mol,B的物质的量为0.4mol,C的物质的量为1.6mol,如图所示,

故答案为:

分析:(1)乙醇能够被氧化为乙醛,然后乙醛可继续被氧化为乙酸;乙醇汽油属于混合物;
(2)A是一种工业制硫酸的含金属元素矿物质主要成分,则A为FeS2,FeS2能燃烧生成SO2,SO2催化氧化生成SO3;
①由图可知,参加反应的B的物质的量为1.6mol,以此计算转化率;
②根据平衡时各物质的浓度及K的定义式来计算;
③相同条件下,相同的容器中投入2mol C,二者为等效平衡,即达到平衡时与上述平衡中各物质的浓度相同,以此来作图.
点评:本题考查无机物的推断及化学平衡的计算,明确乙醇的性质及工业制硫酸的反应、化学平衡常数、转化率的计算即可解答,注意等效平衡的应用来解答最后一问,题目难度不大.

练习册系列答案
相关题目




 现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.
现有3种化合物A、B、C均含短周期元素R,其转化关系如图所示.