题目内容
11.将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )| A. | 二氧化硫 氯气 | B. | 二氧化氮 二氧化硫 | ||
| C. | 氨气 二氧化碳 | D. | 氯气 二氧化碳 |
分析 A.氯气与二氧化硫反应生成硫酸和盐酸;
B.二氧化氮与二氧化硫在溶液中反应生成硫酸根离子;
C.氨气与二氧化碳反应生成碳酸铵;
D.氯气、二氧化碳均氯化钡溶液之间均不反应.
解答 解:A.氯气与二氧化硫反应生成硫酸和盐酸,然后与氯化钡反应生成硫酸钡白色沉淀,故A不选;
B.二氧化氮与二氧化硫在溶液中反应生成硫酸根离子,然后与氯化钡反应生成硫酸钡白色沉淀,故B不选;
C.氨气与二氧化碳反应生成碳酸铵,然后与氯化钡溶液反应生成碳酸钡白色沉淀,故C不选;
D.氯气、二氧化碳均氯化钡溶液之间均不反应,不会有沉淀生成,故D选;
故选D.
点评 本题考查二氧化硫的性质,为高频考点,侧重元素化合物性质的考查,涉及氧化还原反应及复分解反应等,综合性较强,题目难度不大,注意强酸制取弱酸的反应应用.

练习册系列答案
相关题目
1.某有机物的结构简式如图.下列有关它的说法正确的是( )
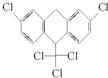

| A. | 该有机物含有一种官能团 | B. | 该有机物含有一个手性碳原子 | ||
| C. | 分子式为C14H8Cl5 | D. | 1mol该物质能与6mol H2加成 |
2.下列说法中正确的是( )
| A. | CCl4的比例模型示意图为 | B. |  的名称为2,6-二甲基3乙基庚烷 的名称为2,6-二甲基3乙基庚烷 | ||
| C. | 化合物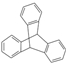 有4种一氯代物 有4种一氯代物 | D. | 1mol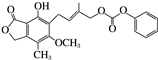 最多能与4molNaOH完全反应 最多能与4molNaOH完全反应 |
6.下列说法正确的是( )
| A. | 碱性锌锰电池的负极是锌 | |
| B. | 在船身装锌块不属于牺牲阳极的阴极保护法 | |
| C. | 电解精炼铜时,杂质Fe、Zn、Ag等沉积在电解槽底部 | |
| D. | 钢铁发生吸氧腐蚀时,负极的电极反应式为 2H2O+O2+4e-═4OH- |
16.下列反应的离子方程式中正确的是( )
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═AlO${\;}_{2}^{-}$+H2↑ | |
| B. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| C. | 向CuSO4溶液中加入Na2O2:Na2O2+2Cu2++2H2O═2Na++2Cu(OH)2↓+O2↑ | |
| D. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
18. 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.
I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
(1)实验I中,前5min的反应速率υ(CO2)=0.1mol/(L.min).
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是BD.
A.容器内压强不再变化 B.n2(H2)=n(H2O)•n(CO)
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO)>αIII(CO) (填:>、<或=,下同),T1>T2,a=$\sqrt{3}$-1(填精确数值).
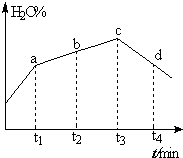
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点υ正>υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(5)CO和H2在一定条件下合成甲醇.甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子.负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.该电池中电流效率为75%.(电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%)
 碳素利用是环保科学家研究的热点课题.
碳素利用是环保科学家研究的热点课题.I.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所 需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | T1 |
| III | 900 | 2 | 2 | a | a | T2 |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是BD.
A.容器内压强不再变化 B.n2(H2)=n(H2O)•n(CO)
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验II和III中CO的平衡转化率:αII(CO)>αIII(CO) (填:>、<或=,下同),T1>T2,a=$\sqrt{3}$-1(填精确数值).
(4)若实验Ⅲ的容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率随时间变化的示意图如图所示,b点υ正>υ逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是该反应达到平衡后,因反应为放热反应且反应容器为绝热容器,故容器内温度升高,反应逆向进行.
(5)CO和H2在一定条件下合成甲醇.甲醇/空气碱性燃料电池中,消耗32g甲醇,电池中有转移4.5mol电子.负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.该电池中电流效率为75%.(电流效率η=$\frac{实际转移电子数}{理论转移电子数}$×100%)
19.下列反应离子方程式正确的是( )
| A. | 向氯化铝溶液中加入过量稀氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 向小苏打溶液中加入醋酸溶液:HCO3-+CH3COOH═CH3COO-+CO2↑+H2O | |
| C. | 苯酚钠溶液中通入二氧化碳CO2+H2O+2C6H5O-→2C6H5OH+CO32- | |
| D. | 向溴化亚铁溶液中通入过量氯气Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
