题目内容
【题目】实验室用下列仪器和药品制取干燥纯净的氯气:
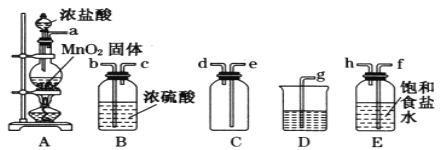
(1)请写出氯元素在元素周期表中的位置______________________;
(2)按气流从左到右,装置正确的连接为a接(___)接(___)接(___)接(___)接(___)接(___) 接g(填各接口字母);
(3)装置A中反应的化学方程式为_____________________________________________;
(4)装置C的作用是____________________,装置E的作用是_____________________;
(5)装置D中反应的离子方程式为______________________________________________;
(6)某校化学兴趣小组称取8.7 g二氧化锰与足量10 mol·L-1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=___________L。
【答案】第三周期第ⅦA族 f h b c e d MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 收集氯气 除掉氯气中混有的HCl气体 Cl2+2OH-=ClO-+Cl-+H2O 2.24
MnCl2+Cl2↑+2H2O 收集氯气 除掉氯气中混有的HCl气体 Cl2+2OH-=ClO-+Cl-+H2O 2.24
【解析】
A装置制备氯气,生成的氯气中含有水蒸气和氯化氢,先后通过饱和食盐水、浓硫酸除去氯化氢和水蒸气,利用向上排空气法收集氯气,最后通过碱液进行尾气处理,据此解答。
(1)氯元素的原子序数是17,氯元素在元素周期表中的位置是第三周期第ⅦA族;
(2)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置,装置A制备氯气,B装置干燥氯气,C装置收集氯气,D装置进行尾气处理,E装置除去氯化氢,由于氯气密度大于空气,利用向上排空气法收集氯气,因此按气流从左到右,装置正确的连接为a接f接h接b接c接e接d接g;
(3)装置A制备氯气,其中反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(4)根据以上分析可知装置C的作用是收集氯气,装置E的作用是除掉氯气中混有的HCl气体;
(5)装置D利用碱液吸收氯气,其中反应的离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O;
(6)8.7 g二氧化锰的物质的量是0.1mol,根据方程式可知与足量浓盐酸反应生成0.1mol氯气,在标况下的体积是2.24L。

【题目】下图是元素周期表的一部分,请回答下列问题:
族/周期 | IA | IIA | III A | IVA | VA | VIA | VIIA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___________________(填元素符号),其⑤的离子结构示意图为____________________。
(2)在这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为____________(填物质的化学式),酸性最强的化合物为________________(填物质的化学式)。
(3)在②和③两种元素中,非金属性较强的是______(填元素名称),②的某种单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式______________________________。
