题目内容
(2012?潍坊一模)常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水④pH=11的NaOH溶液.下列说法正确的是( )
分析:pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,
A.根据酸、碱的物质的量大小确定溶液的酸碱性;
B.根据碱的物质的量确定消耗硫酸的体积;
C.酸和镁反应生成氢气的量与酸的物质的量成正比;
D.根据酸、碱的相对强弱确定稀释后酸、碱的pH.
A.根据酸、碱的物质的量大小确定溶液的酸碱性;
B.根据碱的物质的量确定消耗硫酸的体积;
C.酸和镁反应生成氢气的量与酸的物质的量成正比;
D.根据酸、碱的相对强弱确定稀释后酸、碱的pH.
解答:解:pH=3的CH3COOH溶液中c(CH3COOH)>10-3 mol/L,pH=3的盐酸中c(HCl)=10-3 mol/L,pH=11的氨水中c(NH3.H2O)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,
A.②和③混合,碱的物质的量远远大于酸的物质的量,所以所得混合溶液的pH大于7,故A正确;
B.c(NH3.H2O)>c(NaOH),所以等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④,故B错误;
C.c(CH3COOH)>c(HCl),所以等体积的①与②分别与足量镁粉反应,生成H2的量:①>②,故C错误;
D.若将四种溶液稀释100倍,溶液pH大小顺序:③>④>②>①,故D错误;
故选A.
A.②和③混合,碱的物质的量远远大于酸的物质的量,所以所得混合溶液的pH大于7,故A正确;
B.c(NH3.H2O)>c(NaOH),所以等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④,故B错误;
C.c(CH3COOH)>c(HCl),所以等体积的①与②分别与足量镁粉反应,生成H2的量:①>②,故C错误;
D.若将四种溶液稀释100倍,溶液pH大小顺序:③>④>②>①,故D错误;
故选A.
点评:本题考查酸碱混合溶液的定性判断,明确强弱电解质的特点是解本题关键,难度中等.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
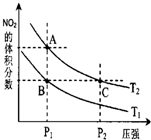 (2012?潍坊一模)反应N2O4(g)?2NO2(g)△H=57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( )
(2012?潍坊一模)反应N2O4(g)?2NO2(g)△H=57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示.下列说法正确的是( ) ,
,