题目内容
【题目】某厂排出的废液主要含Zn(NO3)2和AgNO3,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤
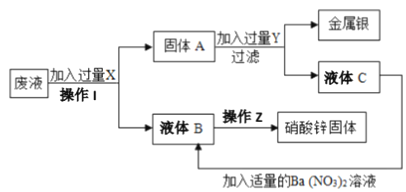
(1)操作I________ (名称)
(2)滤液B的主要成分是______________。(写化学式)
(3)请写出A到C的方程式 _________________________________________________。
【答案】 过滤 Zn(NO3)2 Zn + H2SO4 = ZnSO4 + H2
【解析】(1)根据流程可得,向废液中加入过量X进行操作I,得到固体A和液体B;向固体A加入过量Y后过滤,得到金属银和液体C;则X为Zn,Zn与AgNO3发生置换反应,生成银单质,操作I为过滤,将生成的Ag和过量的Zn与Zn(NO3)2溶液分离。(2)Zn与AgNO3在溶液中反应生成Zn(NO3)2和Ag单质,故滤液B的主要成分是Zn(NO3)2。(3)固体A是Ag和Zn的混合物,加入过量Y得到Ag和液体C,则Y能溶解Zn而不溶解Ag,故Y可以是稀硫酸,则A到C的化学方程式为:Zn+H2SO4=ZnSO4+H2↑。

练习册系列答案
相关题目