题目内容
【题目】(1)某气态氧化物的化学式为RO2,在标准状况下,1.28 g该氧化物的体积为448 mL,则该氧化物的摩尔质量为___________,R 的相对原子质量为_____________。
(2)已知CO、CO2的混合气体质量共14.4 g,标准状况下体积为8.96L,则可推知该混合气体中含CO________g。
(3)质量比为51∶32∶34的NH3、CH4、H2S,所含质子数之比为_____。
(4)质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水。得到的溶液每亳升质量为q g,物质的量浓度为c。则溶质的相对分子质量为_______。
【答案】 64 g/mol 32 5.6 15∶10∶9 1000q(am+bn)/c(m+n-p)
【解析】(1)设该氧化物摩尔质量为M,在标准状况下,1.28 g该氧化物的体积为448 mL,即(1.28g/M)×22.4L·mol-1=0.448L,解得M=64g·mol-1;MR+32=64,则MR=32(g·mol-1);故氧化物的摩尔质量为:64 g·mol-1 ;R 的相对原子质量为32;(2)混合气体的体积为8.96L,则物质的量为8.96L/22.4L·mol-1=0.4mol,设混合气体中CO的物质的量为xmol,CO2的物质的量为ymol,则28x+44y=14.4,x+y=0.4,解得x=0.2mol,y=0.2mol,所以m(CO)=0.2mol×28g·mol-1=5.6g;(3)质量比为51∶32∶34的NH3、CH4、H2S,物质的量之比为51/17∶32/16∶34/34=3:2:1,所含质子数之比为3×10:2×10:1×18=15∶10∶9;(4)蒸发掉Pg水后溶质质量分数为: ![]() ,根据c=
,根据c=![]() ,可知M=
,可知M=![]() ,溶质的摩尔质量M=
,溶质的摩尔质量M=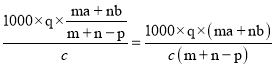 g·mol-1,所以溶质的相对分子质量为:
g·mol-1,所以溶质的相对分子质量为: ![]() 。
。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案



