题目内容
【题目】根据题意解答
(1)溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图1所示. 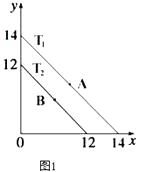
①若从A点到B点,可采取的措施为
②T2℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH﹣)将(填“增大”、“减小”、“不变”).
③已知:T1℃时,醋酸的电离常数为 1.8×10﹣5 , 则 T1℃时,在 0.5molL﹣1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍 .
④T2℃时,将某溶液(此溶液满足 lg[ ![]() ]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
]=10)滴入含 Na+、HS﹣、SO42﹣、K+的溶液中,发生反应的离子方程式为 .
(2)体积均为1mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图2所示: 
①m的取值为 .
②a点酸的浓度b点酸的浓度(填“>”、“<”、“=”).
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是 .
A.c(A﹣) B.n(H+)n(OH﹣) C. ![]() D.
D. ![]()
(3)已知:25℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10﹣10 , K1=4.3×10﹣7、K2=5.6×10﹣11 , 向NaCN溶液中通入少量CO2 , 所发生反应的离子方程式为:
【答案】
(1)升高温度;减小;9×108;HS﹣+OH﹣=S2﹣+H2O
(2)2<m≤4;<;BC
(3)CN﹣+H2O+CO2=HCN+HCO3﹣
【解析】解:(1)①A点时Kw=10﹣14 , B点时Kw=10﹣12 , 从A点到B点Kw增大,所以可采取的措施为升高温度;所以答案是:升高温度;②将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,溶液中氢离子浓度增大,由Kw=c(H+)×c(OH﹣)可知,c(OH﹣)减小,溶液中氢氧根离子由水电离,所以水电离出的c(OH﹣)将减小;
所以答案是:减小;③已知:T1℃时,醋酸的电离常数为 1.8×10﹣5 , 由Ka= ![]() 可知,c(H+)=
可知,c(H+)= ![]() =3×10﹣3mol/L,由Kw=c(H+)×c(OH﹣)=10﹣14可知,水电离出的 c(H+)=
=3×10﹣3mol/L,由Kw=c(H+)×c(OH﹣)=10﹣14可知,水电离出的 c(H+)= ![]() ×10﹣11mol/L,则由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍9×108;
×10﹣11mol/L,则由醋酸电离出的 c(H+)约是水电离出的 c(H+)的倍9×108;
所以答案是:9×108;④T2℃时,Kw=10﹣12 , 将某溶液(此溶液满足 lg[ ![]() ]=10),则c(H+)=10﹣11mol/L,溶液显碱性,所以溶液中HS﹣不能大量共存,发生的离子方程式为:HS﹣+OH﹣=S2﹣+H2O;
]=10),则c(H+)=10﹣11mol/L,溶液显碱性,所以溶液中HS﹣不能大量共存,发生的离子方程式为:HS﹣+OH﹣=S2﹣+H2O;
所以答案是:HS﹣+OH﹣=S2﹣+H2O;(2)①体积均为1mL pH=2的一元酸HA和HB,加水稀释100倍,若HA为强酸,则pH变化为2,若HA为弱酸,则pH变化小于2,所以m的取值范围为:2<m≤4;
所以答案是:2<m≤4;
②稀释相同的倍数HB的pH变化小,则HB的酸性弱,所以a点酸的浓度<b点酸的浓度;
所以答案是:<;
③若 m<4,则HA为弱酸,加水稀释促进电离,
A.加水稀释促进电离,n(A﹣)增大,但是c(A﹣)减小,故A错误;
B.c(H+)×c(OH﹣)不变,由于体积增大,所以n(H+)n(OH﹣)增大,故B正确;
C.加水稀释促进电离,n(A﹣)增大,n(H+)增大,由于c(H+)减小,所以水电离的n(H+)也增大,所以 ![]() 增大,故C正确;
增大,故C正确;
D. ![]() =
= ![]() ,由于水解常数Kh不变,所以
,由于水解常数Kh不变,所以 ![]() 不变,故D错误.
不变,故D错误.
所以答案是:BC;(3)依据强酸制取弱酸的原理,NaCN溶液中通入少量的CO2离子方程式为:CN﹣+H2O+CO2=HCN+HCO3﹣ ,
所以答案是:CN﹣+H2O+CO2=HCN+HCO3﹣ .