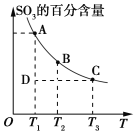
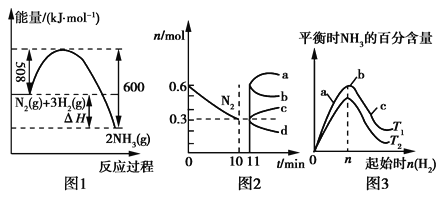
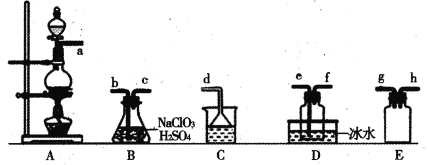
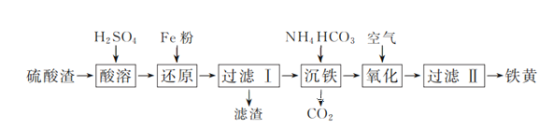
��Ŀ����
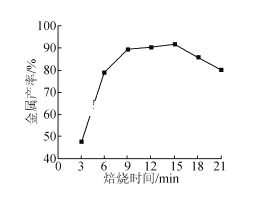
����Ŀ���ȼ��仯���������������ж�����Ҫ��Ӧ�á�
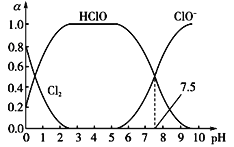
(1)��֪HClO��ɱ��������ClO-ǿ��25��ʱ����������ˮ�γ���������ˮ��ϵ������ϵ��Cl2��HClO��ClO-�����ʵ���������a����pH�仯�Ĺ�ϵ��ͼ��ʾ����ͼ������Ҫʹ��ˮ��ɱ��Ч����ã�Ӧ������Һ��pH��Χ��_____________����pH=7.5ʱ����ˮ�к���Ԫ�ص�����_____________________��
(2)��ҵ����������ʯ��������Ư�۵Ļ�ѧ����ʽΪ_______________________��
(3)��������(ClO2)�ǹ����Ϲ��ϵĸ�Ч����ȫ��ɱ������������ҵ���Ʊ�ClO2�ķ�ӦΪ2KClO3 + H2C2O4 + H2SO4 = K2SO4 + 2ClO2��+ 2X + 2H2O��
��X�Ļ�ѧʽΪ______________��
��ClO2��Cl2���������г��õ���������ClO2������Ч����Cl2��_______��������Ч�������ʵ�λ���ʵ����õ��ĵ�������ʾ����ԭ�����ΪCl-����
���𰸡�2 < pH < 6 HClO��ClO-��Cl- 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O CO2 2.5
��������
(1)HClO��ɱ��������ClO��ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ϵ�д��ڵ�ƽ����������ˮ��Ӧƽ�⡢������ĵ���ƽ�⡢�������ܽ�ƽ�⣻
(2)��������ʯ���鷴Ӧ�����Ȼ��ơ�������ƺ�ˮ��
(3)�ٹ�ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��2KCIO3+H2C2 O4+H2SO4��K2SO4+2ClO2+2X+2H2O��ԭ���غ�õ�X�Ļ�ѧʽ��
��ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ����ݵ����غ������
(1)HClO��ɱ��������ClO��ǿ����HClO����Խ����ɱ��Ч��Խ�ã�����ͼ֪��pH��2��6ʱHClO�����ϸߣ�����2 < pH < 6 ʱƯ��Ч���Ϻã����ȵ����ʴ���ƽ���״̬Ϊ������ˮ��Ӧ�����������ƽ�⣬Һ̬��������̬������ƽ��ȣ���������ˮ��ϵ�У����ڶ������Ԫ�ص�ƽ���ϵ���ֱ���ƽ�ⷽ��ʽ��ʾΪCl2(aq)+H2OHClO+H++Cl����HClOH++ClO����Cl2(g)Cl2(aq)����pH��7.5ʱ����ˮ�к���Ԫ�ص����У�HClO��ClO����Cl����
(2)��ҵ����������ʯ���鷴Ӧ����Ư�۵Ļ�ѧ����ʽΪ��2Cl2+2Ca(OH)2��CaCl2+Ca(ClO)2+2H2O��
(3)�ٹ�ҵ���Ʊ�ClO2�ķ�Ӧԭ��Ϊ��2KCIO3+H2C2 O4+H2SO4��K2SO4+2ClO2+2X+2H2O��ԭ���غ�õ�XΪCO2��
��ClO2��Cl2�Ļ�ԭ���ﶼΪCl����ÿĦ��Cl2�õ�2mol���ӣ���ÿĦ��ClO2�õ�5mol���ӣ�������Cl2�����ʵ�����ClO2��2.5����