题目内容
10.如图中A-J分别代表有关反应中的一种物质,它们均为中学化学中的常见物质.已知A-E和F-J中分别含有同一种元素.反应E→A+O2的条件未标出.请填写下列空白:
(1)化合物H中的阳离子是Fe2+;D的化学式是Al(OH)3.
(2)A生成B反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)B和C反应的离子方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(4)A和F反应的化学方程式是Ai3++3AlO2-+6H2O=4Al(OH)3↓.
(5)I→J反应的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3,该反应过程中发生的实验现象是白色絮状沉淀变为灰绿色,最后变为红褐色.
分析 A能和酸反应也能和碱反应,说明A具有两性,且B和C能发生反应生成D,D加热生成E,E生成A和氧气,且A到E中都含有同一元素,则这几种物质中都含有铝元素,电解氧化铝生成铝和氧气,则E是Al2O3,A是Al,D是Al(OH)3,B为偏铝酸盐,C是铝盐;
铝和F能在高温下发生反应生成G和氧化铝,则该反应为铝热反应,F为金属氧化物,G是金属单质,G和酸反应生成盐H,H和氢氧根离子反应生成氢氧化物I,I能被氧气氧化生成J,J分解生成F,能被空气中氧气氧化的氢氧化物是Fe(OH)2,则I是Fe(OH)2,J是Fe(OH)3,F是Fe2O3,G是Fe,H为亚铁盐,结合物质的性质分析解答.
解答 解:A能和酸反应也能和碱反应,说明A具有两性,且B和C能发生反应生成D,D加热生成E,E生成A和氧气,且A到E中都含有同一元素,则这几种物质中都含有铝元素,电解氧化铝生成铝和氧气,则E是Al2O3,A是Al,D是Al(OH)3,B为偏铝酸盐,C是铝盐;
铝和F能在高温下发生反应生成G和氧化铝,则该反应为铝热反应,F为金属氧化物,G是金属单质,G和酸反应生成盐H,H和氢氧根离子反应生成氢氧化物I,I能被氧气氧化生成J,J分解生成F,能被空气中氧气氧化的氢氧化物是Fe(OH)2,则I是Fe(OH)2,J是Fe(OH)3,F是Fe2O3,G是Fe,H为亚铁盐,
(1)通过以上分析知,H中阳离子是Fe2+,D是 Al(OH)3,
故答案为:Fe2+;Al(OH)3;
(2)A是铝,铝和强碱反应生成偏铝酸盐和氢气,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)铝和氧化铁发生铝热反应,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(4)铝盐和偏铝酸盐反应生成氢氧化铝,离子反应方程式为:Ai3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Ai3++3AlO2-+6H2O=4Al(OH)3↓;
(5)氢氧化亚铁被空气氧化生成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,反应现象为白色絮状沉淀变为灰绿色,最后变为红褐色,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ;白色絮状沉淀变为灰绿色,最后变为红褐色.
点评 本题以铝、铁为载体考查了无机物的推断,以“铝的两性及铝热反应”为突破口采用正逆相结合的方法进行推断,明确物质的性质及物质之间的转化是解本题关键,难点是离子方程式的书写,难度中等.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 水总是自发地由高处往低处流 | |
| B. | 有序排列的火柴散落时成为无序排列 | |
| C. | 放热反应容易进行,吸热反应不能自发进行 | |
| D. | 多次洗牌以后,扑克牌的毫无规律的混乱排列的几大 |
 ?
? ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
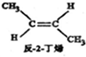
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 |
| A. | K+、Na+、H+、C1- | B. | Na+、Ba2+、Mg2+、NO3- | ||
| C. | NH4+、K+、Cl-、NO3- | D. | K+、Na+、CO32-、S2- |
| A. | 少量的Ba(OH)2溶液滴加到NaHCO3溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
 已知:2NO2(g)═N2O4(g),N2O4为无色气体.
已知:2NO2(g)═N2O4(g),N2O4为无色气体.
 化学是一门以实验为基础的自然科学,如图为某试剂瓶上的标签,试回答下列问题.
化学是一门以实验为基础的自然科学,如图为某试剂瓶上的标签,试回答下列问题.