题目内容
(15分)2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25molH2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
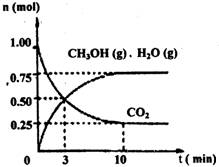
①从反应开始到平衡,氢气的平均反应速率v(H2)= 。
②下列措施中一定不能使n(CH3OH)/n(CO2)增大的是: 。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO 2水溶液的pH =5.6,c(H2CO3)=1.5 ×l0-5mol·L-1。若 忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3- +H+的电离平衡常数K= 。(已知:10 -5.6=2.5×l0-6)。
(3)标准状况下,将1.12LCO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为 ;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是 (填“乙醇”或“氧气”),b处电极上发生的电极反应是: 。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(1)①0.1125mol/(L·min) (3分。无单位或错误不给分,时间以秒为单位且正确也可) ②D(2分。多答不给分)
(2)4.2×10-7 (2分)
(3)c(Na+)>c(CO2-3)>c(OH-)>c(HCO-3)>c(H+)(2分)
(4)乙醇(1分),O2 + 4e-+ 2H2O = 4OH- ( 2分)
(5)5.6×10—5mo1/L (3分)
解析:

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A、NO2 | B、SO2 | C、H2S | D、CO2 |
| A、减少一次性用品的使用 | B、利用太阳能蒸馏海水进行海水的淡化 | C、倡导自驾出行,避开公共交通的拥挤 | D、海水和淡水交汇处安装半透膜,利用水中电解质浓度的差异进行发电 |
 LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,导电固体为电解质.高铁酸钾-锌电池反应:3Zn+2K2FeO4+8H2O
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,导电固体为电解质.高铁酸钾-锌电池反应:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH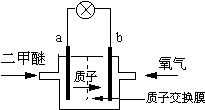 哥本哈根气候变化峰会自2009年12月7日开幕以来,就被冠以“有史以来最重要的会议”、“改变地球命运的会议”等各种重量级头衔.纵然世界各国仍就减排问题进行着艰苦的角力,但低碳这个概念几乎得到了广泛认同.中国慈善首富陈光标2010年11月5号创作的低碳之歌--《让我们再回到从前》让低碳概念融入到每个人的生活之中,减碳是每个人的责任.新能源开发中的燃料电池是低碳研究的重要领域.
哥本哈根气候变化峰会自2009年12月7日开幕以来,就被冠以“有史以来最重要的会议”、“改变地球命运的会议”等各种重量级头衔.纵然世界各国仍就减排问题进行着艰苦的角力,但低碳这个概念几乎得到了广泛认同.中国慈善首富陈光标2010年11月5号创作的低碳之歌--《让我们再回到从前》让低碳概念融入到每个人的生活之中,减碳是每个人的责任.新能源开发中的燃料电池是低碳研究的重要领域.