题目内容
7.下列有关中和热的说法正确的是( )| A. | 中和热的热化学方程式:H+(l)+OH-(l)═H2O(l)△H=-57.3 kJ/mol | |
| B. | 准确测量中和热的实验过程中,至少需测定温度4次 | |
| C. | 环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| D. | 若稀酸溶液中H+与稀碱溶液中OH-的物质的量相等,则所测中和热数值更准确 |
分析 A.氢离子和氢氧根离子的状态为“aq”;
B.准确测量中和热的实验过程,一般要测三次温度;
C.铜导热性能强于玻璃;
D.为了使反应充分进行,应使一方过量,而不是使二者物质的量相等.
解答 解:A.中和热的热化学方程式为H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,故A错误;
B.准确测量中和热的实验过程,一般要测三次温度,故B错误;
C.中和热测定实验成败的关键是保温工作,金属铜的导热效果好于环形玻璃搅拌棒,所以测量出的中和热数值偏小,故C正确;
D.中和反应热的测定应使盐酸充分反应,需加入稍过量的NaOH溶液减少盐酸的挥发,减少误差,故D错误;
故选C.
点评 本题考查了中和热的定义和中和热的测定实验,注意测定中和热的关键是保温,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.将0.1mol的(A)Na; (B) Na2O; (C) Na2O2; (D) NaOH 各加入100mL水,充分搅拌,使固体全部溶解,则所得A,B,C,D溶液中溶质的质量分数按由小到大的顺序排列为( )
| A. | A<B<C<D | B. | D<A<B=C | C. | A=B<C=D | D. | D<A<B<C |
18.如表是元素周期表的一部分.(注意:以下各空请用化学术语答题,不能用字母代替)
(1)A~H八种元素中:
a.原子半径最小的元素对应的单质是F2,还原性最强的单质是K.
b.最高价氧化物对应的水化物酸性最强的酸的化学式是HClO4.
(2)C元素的离子结构示意图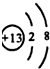 ,用电子式表示AD2的形成过程
,用电子式表示AD2的形成过程 .
.
(3)G元素的最高价氧化物的电子式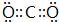 .
.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A |
a.原子半径最小的元素对应的单质是F2,还原性最强的单质是K.
b.最高价氧化物对应的水化物酸性最强的酸的化学式是HClO4.
(2)C元素的离子结构示意图
 ,用电子式表示AD2的形成过程
,用电子式表示AD2的形成过程 .
.(3)G元素的最高价氧化物的电子式
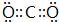 .
.
15.X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径X>Y,Y2-与M+的电子层结构相同,Z与X的原子核外最外层电子数相同,Z的单质可制成半导体材料.下列说法不正确的是( )
| A. | 晶体 H2Y的分子之间为密集堆积 | |
| B. | XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 | |
| C. | 单质M的晶体是体心立方堆积,M的配位数是8 | |
| D. | 由元素X与Z形成的化合物中只含共价键 |
2.下列说法正确的是( )
| A. | 钠原子与氯气分子反应生成氯化钠后,其结构的稳定性增强 | |
| B. | 选择燃料只要考虑燃料燃烧值的大小 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 两个原子之间的相互作用叫化学键 |
12.同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断正确的是( )
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3>YH3>ZH3 | ||
| C. | 元素的非金属强弱:X>Y>Z | D. | 电子层数:X>Y>Z |
19.用干燥的烧瓶收集氨气做喷泉实验,结果发现进入烧瓶的水占烧瓶总体积的$\frac{2}{3}$,则所收集的气体对空气(相对质量为29)的相对密度约为( )
| A. | 0.59 | B. | 0.72 | C. | 0.84 | D. | 0.91 |