题目内容
A、B、C、D、E五种短周期元素,F为第四周期过渡元素,核电荷数依次增加。
元素 有关性质及结构信息
A A的一种原子内无中子
B B原子的电子填充了4个原子轨道
C C22—离子与电负性最大的元素的单质互为等电子体
D D是短周期金属性最强的元素
E C与E同族
F 外围电子排布式为nd2n(n+1)s(n-1)
(1)E2-基态核外电子排布式 ,D单质的晶胞为体心立方,其配位数是 ,C的氢化物在同族元素中沸点反常,其原因是 。
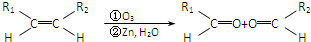
(2)由A、B两种元素组成的非极性分子有多种,其中乙是一个分子含4个原子的的分子,乙的结构式是 。已知1g乙完全燃烧热为46.16 kJ,乙燃烧热的热化学反应方程式是 。
(3)甲是由A、B、C三种元素组成的相对分子质量最小的物质。甲的中心原子的杂化方式是 。由甲中的两种元素组成,且与甲的电子数相等的物质的分子式是 ,该物质与C的单质在K2CO3溶液中形成燃料电池的负极反应式为 。
(4)分别由A、C、D、E四种元素中的3种组成的两种物质丙和丁在溶液中反应生成气体和沉淀,该化学方程式是 。
(5)C与D形成一种物质戊,将过量戊加入过量F与稀硫酸反应后的溶液,得到红褐色沉淀和气体,发生反应的离子方程式是 。
(1)1s22s22p63s23p6, 8 , H2O分子之间存在氢键
(2)H-C≡C-H C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=—1200kJ/mol
(3)sp2 C2H4 C2H4-12e-+6H2O+14CO32-=16HCO3-
(4)Na2S+2H2SO4(浓)=S↓+SO2↑+Na2SO4+2H2O (5)4Na2O2+4Fe2++6H2O=4Fe(OH)3↓+8Na++O2↑
【解析】
试题分析:根据给定条件可知这六种元素分别是:A: H; B :C; C:O; D:Na; E:S; F;Fe。(1)S2-基态的核外电子排布式是1s22s22p63s23p6。Na的晶胞是体心立方结构配位数是8.H2O的沸点反常是因为在水分子间除了有一般的分子间作用力外还有氢键存在。增加了分子间的相互作用。使物质融化或汽化消耗的能量增多,所以熔点、沸点反常。(2)有C、H两元素形成的四原子分子是C2H2.它的结构式是H-C≡C-H。乙炔燃烧的热化学方程式是:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);ΔH=—1200kJ/mol (3)由C、H、O三种元素形成的相对分子质量最小的物质是CH3OH。它的中心原子C原子的杂化方式是SP2。由甲中的两种元素组成,且与甲的电子数相等的物质的分子式是C2H4.乙烯和氧气在K2CO3溶液中形成燃料电池的负极反应式为:C2H4-12e-+6H2O+14CO32-=16HCO3- (4)由H 、O、 S 、Na四种元素中的三种3种组成的两种物质丙和丁在溶液中反应生成气体和沉淀,该化学方程式是Na2S+2H2SO4(浓)=S↓+SO2↑+Na2SO4+2H2O。(5)C与D形成一种物质戊Na2O2,将过量戊加入过量F与稀硫酸反应后的溶液FeSO4中,发生反应得到红褐色沉淀和气体,反应的离子方程式是 4Na2O2+4Fe2++6H2O=4Fe(OH)3↓+8Na++O2↑
考点:考查元素的推断、元素与化合物的性质、晶体结构与性质热化学方程式的书写等知识。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案



 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )