题目内容
【题目】一元酯G是一种重要的化工产品,可以丁二烯为原料通过以下系列化学反应得到。

请完成下列各题:
(1)写出反应类型:反应①___________反应④__________反应③____________
(2)写出反应条件:反应③________________反应⑥__________________
(3)反应②③的目的是:___________________________________________。
(4)写出反应⑤的化学方程式:_____________________________________。
(5)写出B与足量氧气在Cu催化下,被氧化成醛的化学反应方程式_____________, 1mol 该醛与足量的银氨溶液反应,可生成Ag的物质的量为________mol。
(6)写出G的结构简式_______________________________________________。
【答案】 加成反应 取代反应 消去反应 NaOH/醇溶液(或KOH醇溶液),加热 NaOH/水溶液,加热 防止双键被氧化 CH2=CHCH2Br+HBr→CH2Br-CH2-CH2Br ![]() 4 HOCH2CH2CH2OOCCH=CHCOOH
4 HOCH2CH2CH2OOCCH=CHCOOH
【解析】由流程中CH2=CH-CH=CH2(1,3-丁二烯)发生反应①生成A,A又转化为HOCH2CH=CHCH2OH,可得:1,3-丁二烯与卤素单质(如Cl2)发生1,4-加成反应生成A(如ClCH2CH=CHCH2Cl),A在氢氧化钠水溶液中加热,水解生成HOCH2CH=CHCH2OH;HOCH2CH=CHCH2OH与HCl发生加成反应生成B为HOCH2CH2CH(Cl)CH2OH;D酸化得到C4H4O4,则D应为盐,结合流程中B→C→D→E的转化可得:C4H4O4为HOOC-CH=CH-COOH,B发生催化氧化生成C为HOOCCH2CH(Cl)COOH,C在氢氧化钠醇溶液中加热发生消去反应生成D为NaOOC-CH=CH-COONa;CH2=CHCH3与溴单质发生α-H取代反应生成CH2=CHCH2Br,CH2=CHCH2Br与HBr发生加成反应生成F为BrCH2CH2CH2Br,F在氢氧化钠水溶液中加热,水解生成HOCH2CH2CH2OH;HOCH2CH2CH2OH与HOOC-CH=CH-COOH发生酯化反应生成G。
(1)由上述分析可知,反应①为1,3-丁二烯与卤素单质发生1,4-加成反应,故反应类型为加成反应;反应④为CH2=CHCH3与溴单质发生α-H取代反应,故反应类型为取代反应;反应③为HOOCCH2CH(Cl)COOH在氢氧化钠醇溶液、加热条件下发生消去反应生成NaOOC-CH=CH-COONa,故反应类型为消去反应。
(2)由上述分析知,反应③的反应条件为:NaOH/醇溶液(或KOH醇溶液)、加热;反应⑥为BrCH2CH2CH2Br水解生成HOCH2CH2CH2OH,故反应条件为:氢氧化钠水溶液、加热。
(3)HOCH2CH=CHCH2OH变为E(HOOCCH=CHCOOH)需要发生氧化反应,而碳碳双键和羟基都容易被氧化,故反应②③的目的是:保护碳碳双键,防止被氧化。
(4)由前面的分析知,反应⑤为:CH2=CHCH2Br与HBr发生加成反应生成F(BrCH2CH2CH2Br),故化学方程式为:CH2=CHCH2Br+HBr→BrCH2CH2CH2Br。
(5)B为HOCH2CH2CH(Cl)CH2OH,与足量氧气在Cu催化下,2个醇羟基都被氧化成醛基,故化学反应方程式为:HOCH2CHClCH2CH2OH+O2![]() OHCCHClCH2CHO+2H2O;OHCCHClCH2CHO与足量的银氨溶液反应化学方程式为:OHCCHClCH2CHO+4Ag[(NH3)2OH]→H4NOOCCHClCH2OONH4+4Ag+6NH3+2H2O,所以1molOHCCHClCH2CHO与足量的银氨溶液反应,可生成4molAg。
OHCCHClCH2CHO+2H2O;OHCCHClCH2CHO与足量的银氨溶液反应化学方程式为:OHCCHClCH2CHO+4Ag[(NH3)2OH]→H4NOOCCHClCH2OONH4+4Ag+6NH3+2H2O,所以1molOHCCHClCH2CHO与足量的银氨溶液反应,可生成4molAg。
(6)由前面的分析知,HOCH2CH2CH2OH与HOOC-CH=CH-COOH发生酯化反应生成G,由G的分子式为C7H10O5可得其结构简式为:HOCH2CH2CH2OOCCH=CHCOOH。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
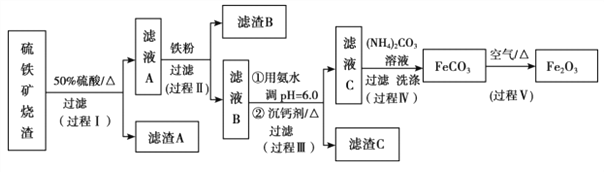
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
已知:生成氢氧化物的 pH 如下表所示
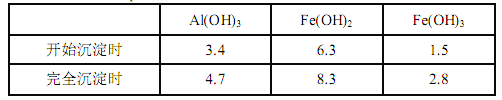
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
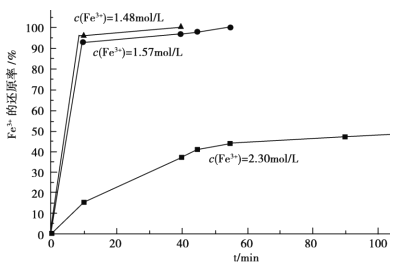
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。


