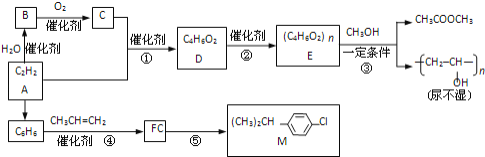
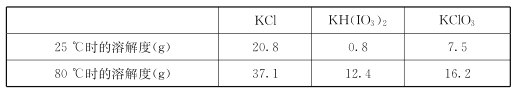
题目内容
【题目】对如图装置(铁的防护)的分析正确的是( )
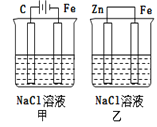
A.甲装置是牺牲阳极的阴极保护法
B.乙装置是牺牲阳极的阴极保护法
C.一段时间后甲、乙装置中pH均增大
D.甲、乙装置中铁电极的电极反应式均为:2H++2e→H2↑
【答案】B
【解析】
甲装置是以碳为阳极,铁为阴极的电解池,实质为电解食盐水,阳极产生氯气,阴极产生氢气;乙装置是以锌为负极,铁为正极的原电池,发生锌的吸氧腐蚀。
A. 甲装置铁为阴极,不参与反应,属于外加电源的阴极保护法,A错误;
B. 乙装置铁为正极,正极氧气得电子,铁不参与反应,是牺牲阳极的阴极保护法,B正确;
C. 甲装置中电解氯化钠溶液生成氢氧化钠,溶液pH增大;乙装置中负极锌失去电子,最终产生氢氧化锌沉淀,溶液中的pH几乎不变,C错误;
D. 甲装置中铁电极水得电子产生氢气,乙装置铁电极氧气得电子产生氢氧根离子,D错误。
答案为B。

练习册系列答案
相关题目