题目内容
5.氯化铁溶液与氢氧化铁胶体具有的共同性质是( )| A. | 分散质粒子直径都在1~100nm之间 | B. | 均能产生丁达尔效应 | ||
| C. | 用漏斗过滤时滤纸上没有滤渣留下 | D. | 均呈红褐色 |
分析 A.溶液和胶体粒子半径大小不同,直径范围不一样;
B.丁达尔效应是胶体的特性;
C.溶液和胶体能透过滤纸;
D.氯化铁溶液颜色呈黄色,氢氧化铁胶体颜色呈红褐色.
解答 解:A.溶液中溶质粒子直径较一般小于1nm,胶体粒子直径在l~100nm之间,二者不同,故A错误;
B.丁达尔效应是胶体的特性,溶液无丁达尔效应,故B错误;
C.溶液和胶体能透过滤纸,没有滤渣留下,故C正确;
D.氯化铁溶液颜色呈黄色,为铁离子的颜色,氢氧化铁胶体颜色呈红褐色,故D错误;
故选C.
点评 本题考查氯化铁溶液和氢氧化铁胶体的区别,涉及到胶体、水解等知识,题目难度不大,注意二者颜色上的区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.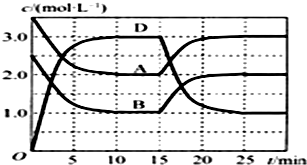 温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
 温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )
温度为T时,向V L的密闭容器中充入一定量的气体A和B,发生反应:A(g)+B(g)?C(s)+x D(g);△H>0,反应过程中容器内A、B、D的物质的量浓度随时间的变化如图所示.下列说法正确的是( )| A. | 该反应的平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{c(A)•c(B)}$ | |
| B. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| C. | 反应至15 min时,改变的条件是升高温度 | |
| D. | 反应在前10 min的平均反应速率:v(D)=0.3 mol•L-1•min-1 |
17.下列离子方程式正确的是( )
| A. | 向NaHSO4溶液中滴加过量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 向碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO2↑+H2O | |
| C. | 向FeCl3溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ | |
| D. | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32- |
14.海波(Na2S2O3•5H2O)可用作脱氯剂、定影剂、解毒剂.硫粉和亚硫酸钠溶液煮沸可得Na2S2O3•5H2O.海波的部分性质如下:易溶于水,不溶于乙醇;熔点48.2℃;在潮湿的空气中易潮解.请回答下列有关实验问题:
(Ⅰ)海波的制取
实验室制备海波过程如下:
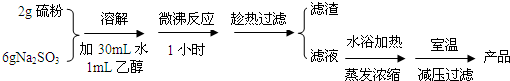
(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
(6)上述四组实验中通过两两比较,能够得出反应速率影响因素的实验组合有4组.
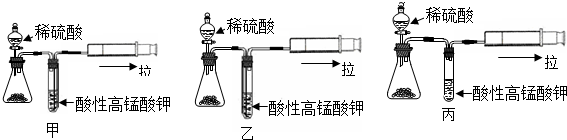
探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.
(Ⅰ)海波的制取
实验室制备海波过程如下:

(1)操作中趁热过滤的原因是防止温度降低时海波的析出,以减少海波的损失.
(2)减压过滤后所得初产品需经过洗涤、干燥,洗涤液采用乙醇,而不用蒸馏水或稀硫酸的原因是海波不溶于乙醇、硫代硫酸钠能溶于蒸馏水(硫不溶于蒸馏水)、硫代硫酸钠能与硫酸反应(S2O32-+2H+=S↓+SO2↑+H2O).

参照丁图简述对海波晶体洗涤的方法关小水龙头,加入乙醇没过产物,让乙醇慢慢通过晶体.
(Ⅱ)海波纯度的测定
碘水滴定硫代硫酸钠的反应原理为:I2+2S2O32-═2I-+S4O62-.某同学用干燥的锥形瓶称取产品ag,向锥形瓶中加适量的蒸馏水使其溶解,再滴加适量淀粉溶液作为指示剂,然后用c mol•L-1的标准碘水滴定,当达到滴定终点时,消耗VmL标准碘水.
(3)判断滴定终点时的现象为当滴加最后一滴标准碘液时,锥形瓶中溶液的颜色由无色变为蓝色且半分钟内不褪色.
(4)该海波(Na2S2O3•5H2O)样品的纯度为$\frac{49.6cV}{a}$%.
(5)下列因素中,导致滴定结果偏高的是BC.
A.锥形瓶未干燥
B.滴定管经水洗后末用标准液润洗
C.滴定前平视,滴定后仰视
D.滴定前,滴定管中的液面处于“0”刻度以下
(Ⅲ)实验探究
探究一:为探究外界条件对化学反应速率的影响因素,取一部分产品与稀硫酸发生反应设计了以下四组实验:
| 组号 | 反应温度(℃) | Na2S2O3 | H2O | H2SO4 | ||
| V/mL | c/mol•L-1 | V/mL | V/mL | c/mol•L-1 | ||
| ① | 10 | 10 | 0.1 | 0 | 10 | 0.1 |
| ② | 10 | 5 | 0.1 | 5 | 10 | 0.1 |
| ③ | 30 | 10 | 0.1 | 0 | 10 | 0.1 |
| ④ | 30 | 5 | 0.1 | 5 | 10 | 0.1 |

探究二:取一部分初产品与稀硫酸反应,为检验实验过程中产生的SO2气体,设计了如图甲、乙和丙的探究装置.
(7)上述装置中最合理的是乙(填“甲”或“乙”或“丙”),写出检验SO2的离子反应方程式5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+.