题目内容
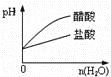
【题目】如图是一稀酸对Fe﹣Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )

A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)═Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
【答案】D
【解析】
A.由图可知,铬的含量大于13%时,稀硝酸对合金的腐蚀速率比盐酸、硫酸弱,故A错误;
B.因硝酸与金属反应生成NO,则稀硝酸和铁反应生成NO,故B错误;
C.盐酸、硝酸氢离子浓度相等,但硝酸腐蚀速度慢,所以不能用氢离子浓度来解释腐蚀速率,故C错误;
D.由图可知,随着Cr含量增加硝酸对合金腐蚀性减弱,故D正确;
故答案为D。

练习册系列答案
相关题目