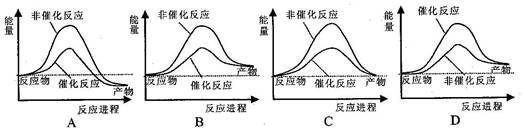
题目内容
下列有关热化学方程式的叙述正确的是
| A.已知2H2(g)+O2(g)= 2H2O(l) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为285.8 kJ·mol-1 |
| B.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)= CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
A
解析试题分析:A、1mol氢气完全燃烧生成液态水,放热285.8 kJ,故氢气的燃烧热为285.8 kJ·mol-1,A正确;B、对于物质的稳定性而言,存在“能量越低越稳定”的规律,由石墨制备金刚石是吸热反应,说明石墨的能量比金刚石低,石墨比金刚石稳定,B错误;C、醋酸的电离是吸热的,因此醋酸和氢氧化钠反应放热小于盐酸和氢氧化钠反应放热,即NaOH(aq)+CH3COOH(aq) = CH3COONa(aq)+H2O(l) ΔH>-57.4 kJ·mol-1,C错误;D、CO燃烧生成CO2放热,即2CO(g)+O2(g) =2CO2(g) ΔH3<0,由盖斯可知ΔH1=ΔH2+ΔH3,即ΔH1-ΔH2=ΔH3<0,故ΔH1<ΔH2,D错误。
考点:考查燃烧热、中和热概念,反应热与物质稳定性的关系,盖斯定律的应用。

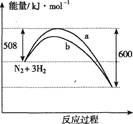
在容积固定不变的密闭容器中加入1 mol N2和3 mol H2发生反应,下列叙述正确的是
| A.该反应的热化学方程式为: N2+3H2  2NH3ΔH =-92 kJ·mol-1 2NH3ΔH =-92 kJ·mol-1 |
| B.达到平衡后向容器中通入1 mol氦气,平衡不移动 |
| C.降低温度和缩小容器体积均可使该反应的平衡常数增大 |
| D.图中曲线b表示使用了催化剂 |
已知反应:H2S(g)+aO2(g)=X+cH2O(l) ΔH,若ΔH表示该反应的标准燃烧热,则X为 ( )
| A.S(s) | B.SO2(g) | C.SO3(g) | D.SO3(l) |
下列说法正确的是( )
| A.物质的化学变化都伴随着能量变化 |
| B.凡是吸热反应都需要加热 |
| C.任何反应中的能量变化都表现为热量变化 |
| D.拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是( )
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是 ( )
A.C(s)+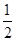 O2(g)=CO(g) ΔH=-393.5 kJ/mol O2(g)=CO(g) ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(g) ΔH=+571.6 kJ/mol |
C.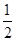 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)ΔH=-1 400 kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
如下图所示,△H1=-393.5 kJ?mol-1,△H2=-395.4 kJ?mol-1,下列说法或表示式正确的是( )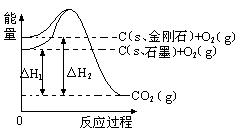
| A.C(s、石墨)=C(s、金刚石) △H="+1.9" kJ?mol-1 |
| B.石墨和金刚石的转化是物理变化 |
| C.金刚石的稳定性强于石墨 |
| D.1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.实验室制备氢气 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与水的反应 | D.铝粉与氧化铁粉末反应 |