题目内容
【题目】在同一条件下,体积相同的三个烧瓶中分别盛有NH3、HCl、NO2气体,并分别倒立在水槽中,充分反应后(已知:3NO2+H2O =2HNO3+NO,NO不溶于水),烧瓶内三种溶液的物质的量浓度之比为(设烧瓶中的溶液未扩散到水槽里)
A. 3:3:2 B. 2:2:3 C. 1:1:1 D. 2:2:1
【答案】C
【解析】
相同条件下,等体积的气体其物质的量相等,氨气和氯化氢极易溶于水,则盛有等体积氯化氢、氨气的烧瓶分别倒立在水槽中时,水会充满整个烧瓶;二氧化氮和水反应方程式为:3NO2+H2O=2HNO3+NO,根据方程式知,水会充入烧瓶的2/3,溶液中的溶质是硝酸,其物质的量是二氧化氮的2/3。
设三种气体体积为标准状况下22.4升,即物质的量为1mol。氨气完全溶于水,水充满整个容器,其物质的量浓度为1mol/22.4L=1/22.4mol/L,氯化氢气体完全溶于水,水充满整个容器,其物质的量浓度为为1mol/22.4L=1/22.4mol/L,由化学方程式:3NO2+H2O=2HNO3+NO可知,1molNO2可生成2/3mol的硝酸,气体体积减少2/3,即进入水的体积为:22.4升×2/3,二氧化氮气体溶于水后生成硝酸物质的量浓度为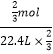 =1/22.4mol/L,则烧瓶内三种溶液物质的量浓度之比为;1:1:1,故选C。
=1/22.4mol/L,则烧瓶内三种溶液物质的量浓度之比为;1:1:1,故选C。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目