题目内容
【题目】A、B、C、D、E五瓶透明溶液,分别是Na2CO3、BaCl2、HCl、NaHSO4、AgNO3中的一种。
①A与D反应有气体生成; ②A与E反应有沉淀生成;
③B与E反应有沉淀生成; ④B与C反应有沉淀生成 ;
⑤C与D反应有气体生成; ⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式是_______________
(2)D为_________________,E为__________________。
(3)B与D反应的离子方程式为____________________________________。
(4)向一定量的Ba(HCO3)2溶液中,逐滴加入C溶液,直至不再生成沉淀,该过程中发生反应的离子方程式为:________________________________,沉淀完全后,继续滴加C溶液,此时发生反应的化学方程式为:__________________________________。
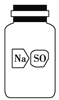
(5)实验室有一瓶标签破损(如图所示)的固体试剂。某同学取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确?________。若正确,请写出相应的离子反应方程式;若不正确,请给出
进一步验证的实验方案(要求:所用试剂只能从A、B、C、D、E中选择):__________________________________________________。
【答案】AgCl Na2CO3 AgNO3 Ba2++CO32-=BaCO3↓ Ba2++SO42-+H++HCO3-=BaSO4↓+H2O+CO2↑ NaHCO3+NaHSO4=Na2SO4+H2O+CO2↑(或H++HCO3-=H2O+CO2↑) 不正确 将沉淀完全的溶液静置,取上层清液于另一试管中,滴加Na2CO3溶液,如有气体产生,说明固体物质是NaHSO4;若无明显现象,则向除去上层清液的试管中滴加盐酸,若滴加时有气体产生,最终沉淀溶解,则固体物质是Na2SO3;若滴加过程中无明显现象,则固体物质是Na2SO4
【解析】
根据⑥“在②和③的反应中生成的沉淀是同一种物质”这一信息可知,A与B中必然含有相同的离子,容易推断出它们是HCl和BaCl2,都可与银离子反应生成AgCl沉淀;因此,E必然是AgNO3;再根据①,A与D反应有气体生成,推断A一定是HCl,那么,B是BaCl2,D是Na2CO3,剩余的一种物质,即NaHSO4就是C。
(1)在②和③的反应中,HCl和BaCl2与硝酸银离反应生成AgCl沉淀,故答案为:AgCl;
(2)由题意分析可知,A是HCl、B是BaCl2、C是NaHSO4、D是Na2CO3、E是AgNO3,故答案为:Na2CO3;AgNO3;
(3)B与D反应为溶液中BaCl2与Na2CO3反应生成碳酸钡沉淀和氯化钠,反应的离子方程式为:Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓;
(4)向一定量的Ba(HCO3)2溶液中,逐滴加入NaHSO4溶液,直至不再生成沉淀,说明溶液中Ba2+离子完全沉淀,HCO3—离子过量,反应的离子方程式为:Ba2++SO42-+H++HCO3-=
BaSO4↓+H2O+CO2↑,沉淀完全后,继续滴加NaHSO4溶液,NaHSO4电离出的H+离子与过量的HCO3-离子反应生成二氧化碳和水,反应的离子方程式为:H++HCO3-=H2O+CO2↑,故答案为:Ba2++SO42-+H++HCO3-=BaSO4↓+H2O+CO2↑;H++HCO3-=H2O+CO2↑;
(5)由示意图可知,该试剂可能为硫酸钠或硫酸氢钠或亚硫酸钠,加入过量BaCl2溶液,硫酸钠、硫酸氢钠和亚硫酸钠均可与BaCl2反应得到白色沉淀,故该同学结论不正确,若要进一步验证,应该用碳酸钠确定溶液中是否存在H+离子,用盐酸确定沉淀是否是亚硫酸钡沉淀,实验方案为:将沉淀完全的溶液静置,取上层清液于另一试管中,滴加Na2CO3溶液,如有气体产生,说明固体物质是NaHSO4;若无明显现象,则向除去上层清液的试管中滴加盐酸,若滴加时有气体产生,最终沉淀溶解,则固体物质是Na2SO3;若滴加过程中无明显现象,则固体物质是Na2SO4,故答案为:不正确;将沉淀完全的溶液静置,取上层清液于另一试管中,滴加Na2CO3溶液,如有气体产生,说明固体物质是NaHSO4;若无明显现象,则向除去上层清液的试管中滴加盐酸,若滴加时有气体产生,最终沉淀溶解,则固体物质是Na2SO3;若滴加过程中无明显现象,则固体物质是Na2SO4。