题目内容
【题目】科学研究发现,三种金属或两种金属可以组成准晶体。某准晶体样品M可能由铁、铜和铝中的三种或两种组成。
【实验目的】探究 ________________ 。
【提出假设】猜想1:M的成分是铁和铜;
猜想2:M的成分是铁和铝;
猜想3:M的成分是______;
猜想4:M的成分是铁、铜和铝
【设计实验】取两份质量均为m g的M样品,按图1和图2装置分别进行实验:实验前后条件都是常温、常压,待样品M充分反应后,按图1、图2实验方案完成实验并测得气体体积分别为V1 L和V2 L(所测定的气体体积已折合成标准状况)。
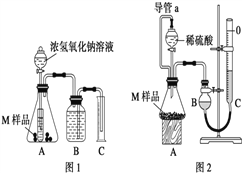
(1)完成实验目的和猜想填空内容。
(2)若该实验需要0.50mol/LNaOH溶液 180mL,按中学常用规格仪器配制时应称量____g NaOH(用托盘天平),若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度_____(填“偏大”、“偏小”或“无影响”)
(3)进行实验1前,B瓶中的水没有装满,使测得的气体体积 _______(填“偏大”、“偏小”或“无影响”),实验2中的导管a的作用为_____________并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。
(4)若V1≠0,则推测上述猜想 ________(填“1”、“2”、“3”或“4”)一定不成立,若猜想3成立,则V1 ________V2(填“>”、“<”或“=”)。
(5)若V1<V2≠0 ,则M样品中铁的质量为____________g(用含V1和V2式子表示)
【答案】 M的成分 铜和铝 5.0 偏大 无影响 平衡压强,使硫酸顺利流下 1 = 0.25(V2—V1)
【解析】实验目的:探究准晶体样品M的成分及含量;关于样品M组成的猜想:两种金属的混合物,有三种情况:铁和铜、铁和铝,还有一种情况是铜和铝;(2)若该实验需要0.50mol·L-1NaOH溶液 180mL,配溶液要用250mL的容量瓶,需要称量NaOH固体m=nM=cVM=0.5mol·L-1×0.25L×40g·mol-1=5.0g;62gNa2O,溶于水能生成2molNaOH,每31g就能获得1molNaOH,若称量的NaOH固体中混有Na2O杂质会导致所配溶液浓度偏大;(3)如果实验前B瓶液体没有装满水,不影响实验结果,因为理论上B管收集的气体体积等于排入C管里液体的体积;实验2中的导管a的作用为平衡压强,使硫酸顺利流下,并能防止因加入液体而排出锥形瓶内部分空气,导致测定的气体体积偏大。(4))若实验1测出有气体产生,说明一定有铝与氢氧化钠反应,猜想1不成立.因为铁和铜都不能与氢氧化钠反应.猜想3成立,M为铜和铝,实验1和实验2使用的样品M质量相等,铜不参与反应,产生的气体体积相等;(5)若猜想2成立,即样品M的成分是铁和铝,则V2-V1即为铁与盐酸反应生成的氢气,所以铁的质量为: ![]() ,则样品M中铁的质量分数为
,则样品M中铁的质量分数为![]() 。
。