题目内容
【题目】下列化学反应属于吸热反应的是( )
A. 碘的升华B. 生石灰溶于水
C. 镁与稀盐酸反应D. 熟石灰与NH4Cl晶体混合制取氨气
【答案】D
【解析】
常见的放热反应有:所有的燃烧反应、金属与酸(或水)的置换反应、所有中和反应、绝大多数化合反应和铝热反应等;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、少数置换反应以及某些复分解反应。
A.碘的升华是碘受热由固态直接变为气态,属于物理变化,A项错误;
B.生石灰与水发生化合反应,属于放热反应,B项错误;
C.镁与稀盐酸反应是置换反应,属于放热反应,C项错误;
D.熟石灰与NH4Cl晶体混合制氨是铵盐和强碱的反应,属于吸热反应,D项正确;
答案选D。

【题目】KMnO4是中学化学常见的试剂。
Ⅰ.某小组拟用酸性KMnO4溶液与H2C2O4(弱电解质)的反应来探究“外界条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20mol/L H2C2O4溶液、0.010mol/L KMnO4酸性溶液、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | 甲 | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
(1)完成上述反应原理的离子反应方程式________
![]()
(2)上述实验①②是探究________对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写________,a为________;
乙是实验需要测量的物理量,则表格中“乙”应填写________。
上述实验②④是探究________对化学反应速率的影响。
Ⅱ.某化学小组利用下图装置进行实验证明氧化性:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4溶液、浓盐酸、浓硫酸
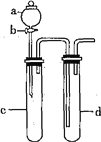
(3)装置a、d中盛放的试剂分别是:________、________;
(4)实验中观察到的现象为________________________________;
此实验装置的不足之处是____________________。
【题目】向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和下图表示:
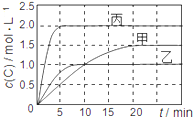
容器 | 甲 | 乙 | 丙 |
容积 | 1L | 1L | 2L |
温度 | T1 | T2 | T2 |
反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
下列说法正确的是 ( )
A. 由图可知:T1<T2,且该反应为吸热反应
B. T1时该反应的平衡常数K=7.2
C. 前10min甲、乙、丙三个容器中A的平均反应速率:v(A)乙<v(A)甲<v(A)丙
D. 平衡时A的质量m:m乙<m甲<m丙
【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
