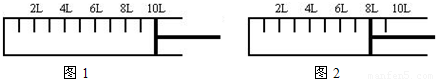题目内容
合成氨的反应原理为:N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
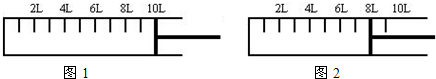
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
(1)A.增大压强平衡向正反应移动,原料利用率提高,氨气产率增大,可以用勒夏特列原理,故A正确;
B.该反应正反应为放热反应,采用500℃的高温,利用平衡向逆反应进行,反应物转化率与产物的产率降低,主要考虑反应速率与催化剂活性,不能用勒夏特列原理,故B错误;
C.用铁触媒作催化剂,加快反应速率,不影响平衡移动,不能用勒夏特列原理,故C错误;
D.生成的氨液化分离,N2、H2循环压缩到合成塔中,利用反应向正反应进行,能用勒夏特列原理,故D正确;
故选AD;
(2)同温同压下,体积之比等于物质的量之比,故平衡后混合气体的总的物质的量为:(6mol+14mol)×
=16mol,混合气体物质的量减少(6mol+14mol)-16mol=4mol,则:
N2(g)+3H2(g)═2NH3(g) 物质的量减少△n
1 2
n(N2) 4mol
故n(N2)=4mol×
=2mol,故氮气的转化率为
×100%=33.3%,
N2(g)+3H2(g)═2NH3(g)
开始(mol):6 14 0
变化(mol):2 6 4
平衡(mol):4 8 4
氮气、氢气、氨气的平衡浓度分别为0.5mol/L、1mol/L、0.5mol/L,
故平衡常数k=
=0.5,
故答案为:33.3%;0.5;
(3)①相同浓度的NaOH溶液与氨水,NaOH溶液的碱性更强,水的电离程度减小,氨水的碱性减弱,水的电离程度更大,故选B;
②氯化钠为强酸强碱盐其溶液呈中性,要使氢氧化钠盐酸混合溶液呈中性,则需要盐酸的物质的量等于氯化钠的物质的量,氯化铵为强酸弱碱盐其溶液呈酸性,要使氨水盐酸混合溶液呈中性,则需要盐酸的物质的量应该稍微小于氨水的物质的量,所以中和等物质的量的氢氧化钠和氨水且使其溶液呈中性,氢氧化钠需要盐酸的物质的量应该大于氨水,故选A;
③一水合氨是弱电解质,溶液中存在电离平衡,等物质的量浓度的氢氧化钠和氨水溶液,氢氧化钠溶液的pH大于氨水,要使稀释后溶液的pH相等,则氢氧化钠溶液加入的水体积大于氨水,故选A.
B.该反应正反应为放热反应,采用500℃的高温,利用平衡向逆反应进行,反应物转化率与产物的产率降低,主要考虑反应速率与催化剂活性,不能用勒夏特列原理,故B错误;
C.用铁触媒作催化剂,加快反应速率,不影响平衡移动,不能用勒夏特列原理,故C错误;
D.生成的氨液化分离,N2、H2循环压缩到合成塔中,利用反应向正反应进行,能用勒夏特列原理,故D正确;
故选AD;
(2)同温同压下,体积之比等于物质的量之比,故平衡后混合气体的总的物质的量为:(6mol+14mol)×
| 8 |
| 10 |
N2(g)+3H2(g)═2NH3(g) 物质的量减少△n
1 2
n(N2) 4mol
故n(N2)=4mol×
| 1 |
| 2 |
| 2mol |
| 6mol |
N2(g)+3H2(g)═2NH3(g)
开始(mol):6 14 0
变化(mol):2 6 4
平衡(mol):4 8 4
氮气、氢气、氨气的平衡浓度分别为0.5mol/L、1mol/L、0.5mol/L,
故平衡常数k=
| 0.52 |
| 0.5×13 |
故答案为:33.3%;0.5;
(3)①相同浓度的NaOH溶液与氨水,NaOH溶液的碱性更强,水的电离程度减小,氨水的碱性减弱,水的电离程度更大,故选B;
②氯化钠为强酸强碱盐其溶液呈中性,要使氢氧化钠盐酸混合溶液呈中性,则需要盐酸的物质的量等于氯化钠的物质的量,氯化铵为强酸弱碱盐其溶液呈酸性,要使氨水盐酸混合溶液呈中性,则需要盐酸的物质的量应该稍微小于氨水的物质的量,所以中和等物质的量的氢氧化钠和氨水且使其溶液呈中性,氢氧化钠需要盐酸的物质的量应该大于氨水,故选A;
③一水合氨是弱电解质,溶液中存在电离平衡,等物质的量浓度的氢氧化钠和氨水溶液,氢氧化钠溶液的pH大于氨水,要使稀释后溶液的pH相等,则氢氧化钠溶液加入的水体积大于氨水,故选A.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目

请回答下列问题:
(2)平衡时反应物的转化率:实验Ⅲ比实验I______(填“大”、“小”或“相同”)。
(3)与实验I比较,实验Ⅱ改变的条件为__________, 判断依据是______________________。
(4)实验Ⅲ的平衡常数K=_________;恒温恒容条件下,向实验Ⅲ达到平衡的容器中通入N2和NH3,使N2 和NH3浓度均变为原平衡的2倍,平衡__________(填编号)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断是否移动
(2)平衡时反应物的转化率:实验Ⅲ比实验I______(填“大”、“小”或“相同”)。
(3)与实验I比较,实验Ⅱ改变的条件为__________, 判断依据是______________________。
(4)实验Ⅲ的平衡常数K=_________;恒温恒容条件下,向实验Ⅲ达到平衡的容器中通入N2和NH3,使N2 和NH3浓度均变为原平衡的2倍,平衡__________(填编号)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断是否移动

 2NH3(g)。实验室模拟化工生产,控制起始浓度均为
2NH3(g)。实验室模拟化工生产,控制起始浓度均为