题目内容
目前,我省多地正在积极推广使用太阳能。常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)Cu+在基态时的价电子排布式为______。
(2)砷、碲是第四周期的相邻元素,已知砷的第一电离能(947kj • mol-1)大于碲 (941 kj • mol-1)。请从原子结构的角度加以解释_________。
(3)As2O3俗名砒霜,是一种剧毒物质。法医检验砒霜中毒的方法是:向试样中加入锌 粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”。请用化学方程式表示检验原理:
__________________、__________________
(4)硼酸(H3BO3)在水溶液中易结合一个OH—生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________。
②[B(OH)4]-的结构式为____________。
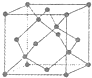
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体 硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂)。
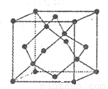
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______ (用化学式表示
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361. 5 pm。
立方氮化硼晶胞中含有______个氮原子、______个硼原子,立方氮化硼的密度是______g • cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(1)3d10(1分)
砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子 需要的能量比较大。(1分)
(3)As2O3+12HCl+6Zn= 6ZnCl2+
2AsH3↑+ 3H2O(2分) 2AsH3 2As+3
H2(2分)
2As+3
H2(2分)
(4)①sp3 (1分)
②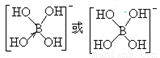 (2分)
(2分)
(5)① C >SiC> Si(2分)
②4 (1分)
4 (1分)
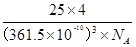 (2分)
(2分)
【解析】
试题分析:(1)铜的核电荷数为29,根据构造原理排列为[Ar]3d104s1,Cu+为失去1个电子后达到全满的结构,故价电子排布为3d10(3)在这个反应中As从+3到-3价,Zn从0价到+2,然后根据化合价升降法进行配平可以得到然后AsH3加热后发生分解,故得到As(5)①,金刚石、晶体硅、碳化硅都是原子晶体,半径越小。熔点越高。②根据分摊原则,立方氮化硼晶体的结构与金刚石相似,晶胞中共有8个原子,N和B各占4个。
考点:考查物质结构,元素周期律,晶胞计算

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
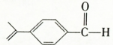
鸿图图书寒假作业假期作业吉林大学出版社系列答案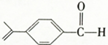 ,紫苏醛不具有的性质是( )
,紫苏醛不具有的性质是( )| A、跟新制Cu(0H)2等发生氧化反应 | B、跟乙醇发生酯化反应 | C、跟氢气等发生加成反应 | D、跟溴单质发生取代反应 |
 [化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
[化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.