题目内容
(1)已知25℃时有关弱酸的电离平衡常数:
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
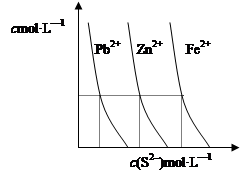
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10—1 | 1.8×10—5 | 4.9×10—10 | K1=4.3×10—7 K2=5.6×10—11 |
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为
(填序号)。
②25℃时,将20 mL 0.1 mol·L—1 CH3COOH溶液和20 mL 0.1 mol·L—1HSCN溶液分别与20 mL 0.1 mol·L—1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 。反应结束后所得两溶液中,c(CH3COO—) c(SCN—)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______(填序号)。
a. c(CH3COO-) b. c(H+) c. Kw d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2—浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是 (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为 (填化学式)沉淀。
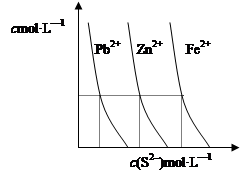
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.1 mol电子通过时, 极增重________g
(13分)(1)① c b d a (2分)
②同浓度的HSCN比CH3COOH酸性强,与NaHCO3溶液反应快(2分) <(1分) ③ a(2分)
(2)FeS (1分) PbS (1分)
(3)①CH4 —8e— + 2H2O=CO2 + 8H+ (2分) ②b(1分) 3.2(1分)
②同浓度的HSCN比CH3COOH酸性强,与NaHCO3溶液反应快(2分) <(1分) ③ a(2分)
(2)FeS (1分) PbS (1分)
(3)①CH4 —8e— + 2H2O=CO2 + 8H+ (2分) ②b(1分) 3.2(1分)
试题分析:(1)①电离平衡常数越小,酸越弱,因此根据电离平衡常数可知,酸性强弱顺序是HSCN>CH3COOH>H2CO3>HCN>HCO3-。酸越弱,相应的钠盐越容易水解,溶液的pH越大,则等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为c>b>d>a。
②根据电离常数可知,同浓度的HSCN比CH3COOH酸性强,所以与NaHCO3溶液反应快;反应结束后得到的是醋酸钠后NaSCN溶液。由于酸性是HSCN比CH3COOH酸性强,所以醋酸钠的水解程度强于NaSCN的水解程度,因此溶液中c(CH3COO—)<c(SCN—)。
③根据图像可知,PbS、ZnS、FeS的溶度积常数依次增大,所以如果向三种沉淀中加盐酸,最先溶解的是FeS。根据溶解平衡可知,沉淀容易向生成更难溶的方向转化,因此向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS沉淀。
(3)①原电池中负极失去电子,正极得到电子。因此在该燃料电池中甲烷在负极通入,氧气在正极通入。由于电解质是酸性电解质,所以负极电极反应式是CH4 —8e— + 2H2O=CO2 + 8H+。
②根据装置图可知,不电极与燃料电池的负极相连,作阴极。溶液中的铜离子在阴极放电,电极反应式是Cu2++2e-=Cu,所以不电极质量增加
 ×64g/mol=3.2g。
×64g/mol=3.2g。
练习册系列答案
相关题目
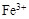 、
、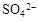 、
、 和X四种离子以物质的量之比
和X四种离子以物质的量之比 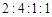 大量共存于同一溶液中,则X
大量共存于同一溶液中,则X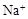
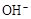
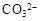

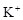 、
、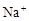 、
、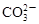 、
、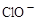
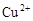 、
、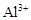 、
、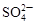 、
、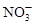
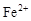 、
、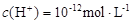 的溶液:
的溶液: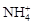 、
、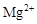 、
、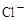 、
、