题目内容
两种金属组成的合金6.5g,与氯气完全反应,消耗氯气7.1g,则合金的组成可能是
| A.Cu和Zn | B.Na和Ag | C.Fe和Ca | D.Cu和Ca |
B
Cu消耗氯气7.1g需质量为6.4g;Zn消耗氯气7.1g需质量为6.5g; Na消耗氯气7.1g需质量为4.6g;Ag消耗氯气7.1g需质量为21.6g; Fe消耗氯气7.1g需质量为37.3g;Ca消耗氯气7.1g需质量为4.0g; 而合金的质量为6.5g,即有一种金属质量小于6.5g,而有一种金属质量应大于6.5g,所以正确选项为B;

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
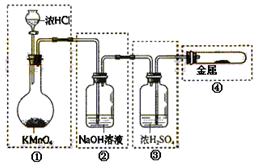
 HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4 地控制次氯酸的浓度,请结合平衡常数解释原因: 。
地控制次氯酸的浓度,请结合平衡常数解释原因: 。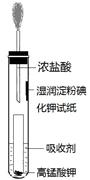
 氯水中只含氯分子
氯水中只含氯分子 天后,几乎无漂白性
天后,几乎无漂白性