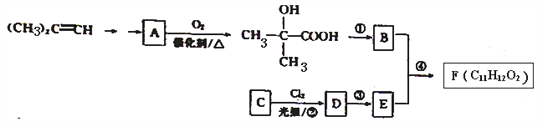
题目内容
【题目】在反应:8NH3+3Cl2==N2+6NH4Cl中,若共得到了28g氮气,试问:
(1)反应耗用的氧化剂的质量;_______________
(2)被氧化的还原剂的质量。_______________
【答案】 213g 34g
【解析】在反应8NH3+3Cl2=6NH4Cl+N2中,氧化剂为氯气,还原剂为氨气,生成28g氮气,即1mol氮气;
(1)反应耗用的氧化剂氯气的物质的量为1mol×3=3mol,则氯气的质量为3mol
(2)被氧化的还原剂是氨气,氧化产物为N2,根据原子守恒可知,被氧化的氨气物质的量为1mol×2=2mol,质量为2mol×17g/mol=34g。

练习册系列答案
相关题目
【题目】在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(I)随新物质加入量(m)的变化曲线。
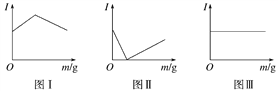
以下4个导电性实验,其中与图Ⅰ、图Ⅱ、图Ⅲ对应一致的选项是( )
①Ba(OH)2溶液中滴入H2SO4溶液至过量
②醋酸溶液中滴入NH3·H2O至过量
③澄清石灰水中通入CO2至过量
④NH4Cl溶液中逐渐加入适量NaOH固体
图 选项 | 图Ⅰ | 图Ⅱ | 图Ⅲ |
A | ① | ② | ③ |
B | ④ | ②③ | ① |
C | ③ | ①② | ④ |
D | ② | ①③ | ④ |
A. A B. B C. C D. D