题目内容
常温下,用 0.1000 mol L-1NaOH溶液滴定 20.00 ml0.1000 mol.L-1CH3COOH溶液,所得滴定曲线如下图所示。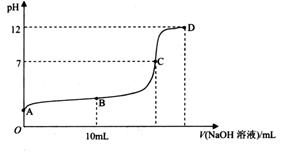
请回答:
(1) 有人认为,C点时NaOH与CH3COOH恰好完全反应,这种看法是否正确______?(选填“是”或“否”),理由是________________________;
(2) 关于该滴定实验,从下列选项中选出最恰当的一项____ (选填字母);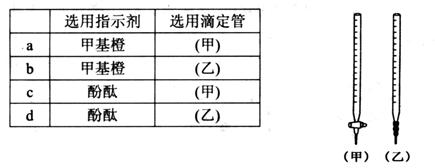
(3) 在B点时,溶液中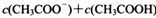 ________
________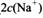 (选填“>”、“<”或“=”);
(选填“>”、“<”或“=”);
(4) 在A?D区间内,下列大小关系可能存在的是________;
①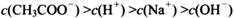
②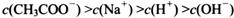
③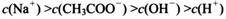
④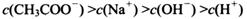
(5) 若向该醋酸溶液中加入少量的醋酸钠晶体,则溶液的pH会____(选填“增大”、“减小”或“不变”);
(6) 常温下,用该NaOH溶液滴定25.00 mL—定浓度的某稀H2SO4溶液,达到滴定终点时消耗NaOH溶液的体积为25.00 mL,则该稀H2SO4溶液的pH=____。

解析

 名师点拨卷系列答案
名师点拨卷系列答案|
常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).下列说法正确的是
| |
| [ ] | |
A. |
点①所示溶液中:c(H+)/c(OH-)=1012 |
B. |
点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) |
C. |
点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
D. |
点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1 |
常温下,用 0.10 mol·L-1 NaOH 溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示:
 | |||
 |
图1 图2
则滴定HC1溶液的曲线是 _▲ (填“图1”或“图2”),说明判断依据 ▲ 。a与b的关系是:a _▲ b(填“>”、“<”或“=”);E点对应离子浓度由大到小的顺序为 _▲ ;




