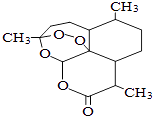
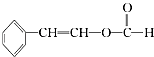题目内容
【题目】碲及其化合物具有许多优良性能,被广泛用于冶金、化工、医药卫生等工业领域.铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)经如下工艺流程如图1得到粗碲.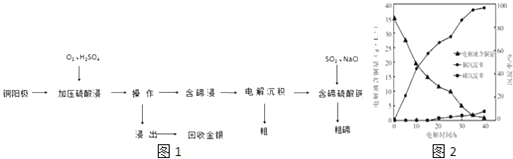
(1)“加压硫酸浸出”过程中会发生以下化学反应:Cu2Te+2O2=2CuO+TeO2;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为 .
②工业上给原料气加压的方法是 .
(2)操作Ⅰ是 .
(3)“含碲浸出液”的溶质成分除了TeOSO4外,主要是(填化学式).
(4)“电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如图2.电解初始阶段阴极的电极反应式是 .
(5)向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72gL﹣1下降到0.10gL﹣1 , Cu2+浓度从7.78gL﹣1下降到1.10gL﹣1 . ①TeOSO4生成Te的化学方程式为 .
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为 .
【答案】
(1)2Ag2Te+3O2=2Ag2O+2TeO2;用压缩机加压
(2)过滤
(3)CuSO4
(4)Cu2++2e﹣=Cu
(5)TeOSO4+2SO2+3H2O=Te+3H2SO4;NaCl比KI价格便宜;98.5%
【解析】解:(1)①Ag2Te也能与O2发生类似Cu2Te的反应,则与氧气反应生成Ag2O和TeO2 , 反应的化学方程式为2Ag2Te+3O2=2Ag2O+2TeO2 , 所以答案是:2Ag2Te+3O2=2Ag2O+2TeO2;②工业上一般用压缩机加压给原料气加压,所以答案是:用压缩机加压;(2)操作Ⅰ用于分离固体和液体,为过滤操作,所以答案是:过滤;(3)由操作Ⅰ可知分离出Ag、Au,则“含碲浸出液”的溶质含有TeOSO4、CuSO4 , 所以答案是:CuSO4;(4)电解液含铜量逐渐减小,电解初始阶段阴极应生成铜,电极方程式为Cu2++2e﹣=Cu,所以答案是:Cu2++2e﹣=Cu;(5)①TeOSO4与二氧化硫发生氧化还原反应生成Te,反应的化学方程式为TeOSO4+2SO2+3H2O=Te+3H2SO4 , 所以答案是:TeOSO4+2SO2+3H2O=Te+3H2SO4;②NaCl比KI的资源丰富,价格便宜,所以工业生产时更节约成本,所以答案是:NaCl比KI价格便宜;③Te(IV)浓度从6.72gL﹣1下降到0.10gL﹣1 , Te(IV)的还原率为: ![]() =98.5%,所以答案是:98.5%.
=98.5%,所以答案是:98.5%.

【题目】在25’C时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
平衡浓度/mol/L | 0. 05 | 0. 05 | 0.1 |
下列说法错误的是
A. 反应达衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 改变温度可以改变此反应的平衡常数