题目内容
金属钠和金属铅的2︰5(摩尔比)的合金可以部分地溶解于液态氨,得到深绿色的溶液A,残留的固体是铅,溶解的成分和残留的成分的质量比为9.44︰1,溶液A可以导电,摩尔电导率的测定实验证实,溶液A中除液氨原有的少量离子(NH4+和NH2-)外只存在一种阳离子和一种阴离子(不考虑溶剂合,即氨合的成分),而且它们的个数比是4︰1,阳离子只带一个电荷。通电电解,在阳极上析出铅,在阴极上析出钠。用可溶于液氨并在液氨中电离的盐PbI2配制的PbI2的液氨溶液来滴定溶液A,达到等当点时,溶液A的绿色褪尽,同时溶液里的铅全部以金属铅的形式析出。回答下列问题:
(1)写出溶液A中的电解质的化学式;
(2)写出上述滴定反应的配平的离子方程式;
(3)已知用于滴定的碘化铅的浓度为0.009854mol/L,达到等当点时消耗掉碘化铅溶液21.03毫升,问共析出金属铅多少克?
附:铅的原子量207.2;钠的原子量22.99。
(1)Na4Pb9;
(2)2Pb2++Pb94-=11Pb;
(3)236.2毫克。
解析:
设合金中金属钠和金属铅的物质的量分别为2a、5a,残留的铅物质的量为b。则有:
![]()
溶液中n(Na):n(Pb)=2a:4.5a=4:9,A的化学式为Na4Pb9
滴定反应为:Na4Pb9+ 2PbI2=11Pb+4NaI,滴定时析出Pb质量为:
![]()
(1)Na4Pb9;
(2)2Pb2++Pb94-=11Pb;
(3)236.2毫克。

练习册系列答案
相关题目
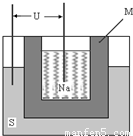
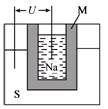
 S=Na2
S=Na2 ,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的
倍。
,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的
倍。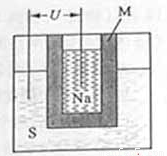
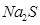 溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体
溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体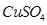 ,溶液Ph (填“增大”“减小”或“不变”),
,溶液Ph (填“增大”“减小”或“不变”),