题目内容
(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:298K时,
C(s,石墨)+ O2(g)= CO2(g) △H1= -393.5kJ/mol
2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol
2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol
写出298K时C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学反应方程式:_____________
C(s,石墨)+ O2(g)= CO2(g) △H1= -393.5kJ/mol
2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol
2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol
写出298K时C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学反应方程式:_____________
2C(s,石墨)+ H2(g)= C2H2(g) △H3=+226.7kJ/mol
考查盖斯定律的应用。根据反应①C(s,石墨)+ O2(g)= CO2(g) △H1= -393.5kJ/mol、
反应②2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol和反应③2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol可知,将①×4+②-③得到4C(s,石墨)+ 2H2(g)= 2C2H2(g),所以该反应的反应热△H=-393.5kJ/mol×4—571.6kJ/mol+2599kJ/mol=+453.4 kJ/mol。
反应②2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol和反应③2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol可知,将①×4+②-③得到4C(s,石墨)+ 2H2(g)= 2C2H2(g),所以该反应的反应热△H=-393.5kJ/mol×4—571.6kJ/mol+2599kJ/mol=+453.4 kJ/mol。

练习册系列答案
相关题目
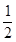 H2(g)+
H2(g)+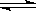 2NH3(g)ΔH ="-92.4" kJ?mol-1,充分反应后放出的热量为
2NH3(g)ΔH ="-92.4" kJ?mol-1,充分反应后放出的热量为 2NH3 (g) ΔH=-92.4 kJ/mol
2NH3 (g) ΔH=-92.4 kJ/mol 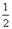 O2(g) △H1 =" +242" kJ·mol-1
O2(g) △H1 =" +242" kJ·mol-1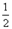 O2(g)="MgO(s) " △H3 = -602kJ·mol-1
O2(g)="MgO(s) " △H3 = -602kJ·mol-1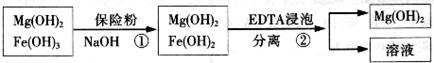
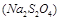 的作用: 。
的作用: 。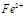 反应生成易溶于水的物质,不与
反应生成易溶于水的物质,不与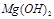 反应。虽然
反应。虽然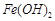 难溶于水,但步骤②中随着EDTA的加入,最终能够将
难溶于水,但步骤②中随着EDTA的加入,最终能够将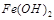 除去并获得纯度高的
除去并获得纯度高的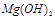 。请从沉淀溶解平衡的角度加以解释 ;
。请从沉淀溶解平衡的角度加以解释 ;