题目内容
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g) B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=____ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
A(g)
 B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=____ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
(1)升高温度、降低压强
(2)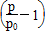 ×100% 94.1%
×100% 94.1%
A(g) B(g) + C(g)
B(g) + C(g)
0.10 0 0
10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=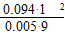 =1.5
=1.5
(3)①0.10×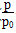 0.10×
0.10×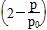 ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
(2)
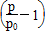 ×100% 94.1%
×100% 94.1%A(g)
 B(g) + C(g)
B(g) + C(g)0.10 0 0
10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=
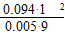 =1.5
=1.5(3)①0.10×
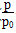 0.10×
0.10×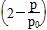 ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013(1)要提高A的转化率,实际就是使平衡正向移动,根据方程式的特点正反应为气体物质的量增大的反应,且为吸热反应,可确定采取的措施。
(2)由阿伏加德罗定律推论可知,在恒温、恒容条件下,压强与物质的量成正比,将压强变化转化为物质的量变化,从而解决压强与转化率的关系。

所以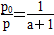 ,解得a=(
,解得a=(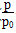 -1) mol。
-1) mol。
α(A)=(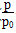 -1)×100%
-1)×100%
平衡时A的转化率=(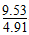 -1)×100%≈94.1%。
-1)×100%≈94.1%。
(3)①与(2)思路相似,应用阿伏加德罗定律推论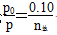 ,得n总=0.10×
,得n总=0.10×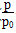 。
。
由方程式特点,应用差量法可知,反应过程增加的气体的物质的量,恰好等于反应的A的物质的量。
即:0.1-n(A)=n(总)-0.1
解得n(A)=0.2-0.1×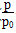
②从上表读出4 h时p=7.31
计算得n(A)=0.2-0.1× ≈0.051
≈0.051
依据此表中相邻两数据的差,即可得出规律。
(2)由阿伏加德罗定律推论可知,在恒温、恒容条件下,压强与物质的量成正比,将压强变化转化为物质的量变化,从而解决压强与转化率的关系。

所以
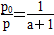 ,解得a=(
,解得a=(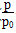 -1) mol。
-1) mol。α(A)=(
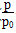 -1)×100%
-1)×100%平衡时A的转化率=(
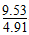 -1)×100%≈94.1%。
-1)×100%≈94.1%。(3)①与(2)思路相似,应用阿伏加德罗定律推论
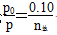 ,得n总=0.10×
,得n总=0.10×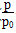 。
。由方程式特点,应用差量法可知,反应过程增加的气体的物质的量,恰好等于反应的A的物质的量。
即:0.1-n(A)=n(总)-0.1
解得n(A)=0.2-0.1×
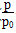
②从上表读出4 h时p=7.31
计算得n(A)=0.2-0.1×
 ≈0.051
≈0.051依据此表中相邻两数据的差,即可得出规律。

练习册系列答案
相关题目
 2Z(g),其平衡常数为1 600
2Z(g),其平衡常数为1 600 CuSO4·3H2O(s)+2H2O(g)
CuSO4·3H2O(s)+2H2O(g)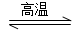 Si3N4(s)+12HCl(g) ΔH<0
Si3N4(s)+12HCl(g) ΔH<0 3C(g),若反应开始时充入2 mol A和1 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
3C(g),若反应开始时充入2 mol A和1 mol B,达到平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( ) 2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放出热量x kJ
2SO3 (g) △H =-a kJ·mol-1(a>0)。恒温恒容下,在10L的密闭容器中加入0.1molSO2和0.05molO2,经过2min达到平衡状态,反应放出热量x kJ CO (g)+H2 (g) ΔH="+131" kJ·mol-1
CO (g)+H2 (g) ΔH="+131" kJ·mol-1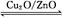 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。