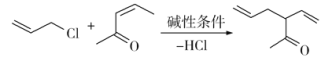
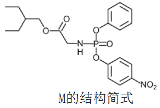
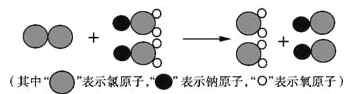
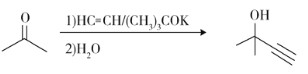题目内容
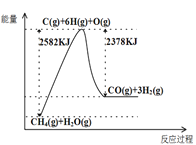
【题目】酸雨的形成是—种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如图:
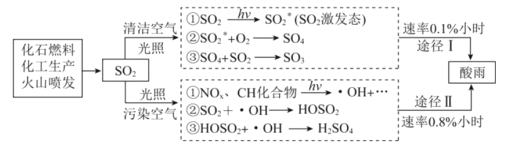
下列有关说法不正确的是
A.所涉及的变化均为氧化还原反应B.光照是酸雨形成的必要条件之一
C.污染指数越高形成酸雨的速率越快D.优化能源结构能有效遏制酸雨污染
【答案】A
【解析】
A.SO2变为激发态SO2没有化合价变化,不属于氧化还原反应,故A错误;
B.由图可知,两种途径中反应1均需要光照条件下发生,所以光照是形成酸雨形成的必要条件之一,故B正确;
C.据图可知,途径II的速率大于途径I,即污染指数越高形成酸雨的速率越快,故C正确;
D.优化能源结构能减少化石燃料的使用,使排放的二氧化硫含量少,能有效遏制酸雨污染,故D正确。
故选:A。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目