题目内容
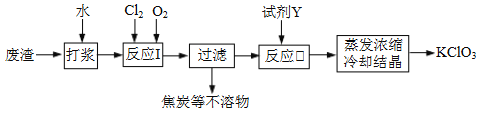
【题目】实验室以一种工业废渣(含80%~90%的Ca(OH)2,其余为焦炭等不溶物)为原料制备KClO3的实验过程如下:
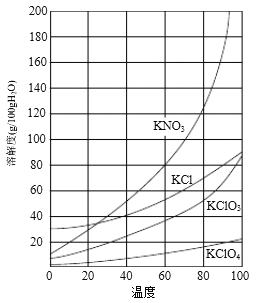
几种物质的溶解度如下图:
⑴反应I的目的是制备Ca(ClO3)2,写出该反应的化学方程式:_____________;在通入Cl2和O2比例、废渣量均一定的条件下,为使Cl2转化完全,可采取的合理措施是____________。
⑵若过滤时滤液出现浑浊,其可能的原因是_____________(填序号)。
A.漏斗中液面高于滤纸边缘 B.滤纸已破损 C.滤纸未紧贴漏斗内壁
⑶所加试剂Y选用KCl而不用KNO3的原因是_____________。
⑷已知:4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
2KCl+3O2↑。实验室可用KClO3制备高纯KClO4固体,实验中必须使用的用品有:热过滤装置(如下图所示)、冰水。
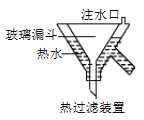
①热过滤装置中玻璃漏斗的下端露出热水浴部分不宜过长,其原因是_____________。
②请补充完整由KClO3制备高纯KClO4固体的实验方案:
向坩埚中加入一定量的KClO3,_____________,在低温下干燥得KClO4固体。
【答案】 2Ca(OH)2+2Cl2+5O2= 2Ca(ClO3)2+2H2O 缓慢通入Cl2、O2(搅拌浆料或控制合适的温度) AB 防止产物KClO3中含有较多的KNO3杂质 防止滤液冷却析出的晶体堵塞漏斗 控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次
【解析】⑴根据流程图,反应I中氯气、氧气和氢氧化钙反应生成了Ca(ClO3)2,反应的化学方程式为2Ca(OH)2+2Cl2+5O2= 2Ca(ClO3)2+2H2O;在通入Cl2和O2比例、废渣量均一定的条件下,充分搅拌浆料或控制合适的温度,可以使Cl2转化完全,故答案为:2Ca(OH)2+2Cl2+5O2= 2Ca(ClO3)2+2H2O;搅拌浆料或控制合适的温度;
⑵当漏斗中液面高于滤纸边缘,滤纸破损均会使滤液出现浑浊,故选AB;
⑶如果所加试剂Y选用KNO3,根据溶解度曲线,产物KClO3中可能含有较多的KNO3杂质,故答案为:防止产物KClO3中含有较多的KNO3杂质;
⑷①如果热过滤装置中玻璃漏斗的下端露出热水浴部分过长,过滤时滤液冷却析出的晶体堵塞漏斗,故答案为:防止滤液冷却析出的晶体堵塞漏斗;
②根据溶解度曲线可知, KClO4的溶解度较小,结合4KClO3![]() 3KClO4 +KCl;2KClO3
3KClO4 +KCl;2KClO3![]() 2KCl+3O2↑,可知,由KClO3制备高纯KClO4固体时:向坩埚中加入一定量的KClO3,控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次,在低温下干燥得KClO4固体,故答案为:控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次。
2KCl+3O2↑,可知,由KClO3制备高纯KClO4固体时:向坩埚中加入一定量的KClO3,控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次,在低温下干燥得KClO4固体,故答案为:控制温度400℃,使KClO3充分分解,将所得固体溶于水并煮沸至有大量固体析出,用热过滤装置过滤,并用冰水洗涤滤渣2~3次。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案