题目内容
在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
分析:先根据质量、摩尔质量与物质的量的关系计算氨的物质的量,再根据物质的量浓度公式计算其物质的量浓度;根据同一反应中各物质的反应速率之比等于其计量数之比计算氢气、氮气的速率.
解答:解:n(NH3)=
=
=0.1mol,v(NH3)=
=
=0.01mol/(L?min),
同一反应中各物质的反应速率之比等于其计量数之比,所以v(N2)=0.005mol/(L?min);
v(H2)=0.015mol/(L?min).
故选B
| m |
| M |
| 1.7g |
| 17g/mol |
| △n |
| V△t |
| 0.1mol |
| 2L×5min |
同一反应中各物质的反应速率之比等于其计量数之比,所以v(N2)=0.005mol/(L?min);
v(H2)=0.015mol/(L?min).
故选B
点评:本题考查的是反应速率的定量表示方法,根据同一反应中各物质的反应速率之比等于其计量数之比是解本题的关键.

练习册系列答案
相关题目
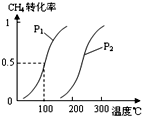 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH).
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH). 十3H
十3H 2NH3,在2L密闭容器中进行,5main内氨的质量
2NH3,在2L密闭容器中进行,5main内氨的质量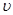 (H
(H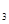 )=0.17g/(L·mitt) D.
)=0.17g/(L·mitt) D.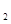 十3H
十3H 2NH3,在2L密闭容器中进行,5main内氨的质量
2NH3,在2L密闭容器中进行,5main内氨的质量 (H
(H )=0.17g/(L·mitt) D.
)=0.17g/(L·mitt) D.