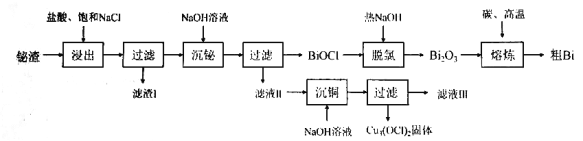
题目内容
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-,HB- ![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B溶液显________(填“酸性”“中性”或“碱性”)。理由是______(用离子方程式表示)。
(2)若0.1mol·L-1的NaHB溶液PH=2,则0.1mol/LH2B溶液中氢离子浓度可能是_________0.11mol/L(填“﹥”“=” 或“﹤”) ,理由是__________。
【答案】碱性 B2-+H2O≒HB-+OH- < 第一步电离产生的H+抑制了第二步的电离
【解析】
某二元酸H2B在水溶液中发生电离的方程式为:H2B=H++HB-,HB- ![]() H++B2-。
H++B2-。
从方程式可以看出,H2B第一步发生完全电离,第二步部分发生电离,所以HB-只发生电离,不发生水解。
(1)Na2B溶液中,B2-发生水解,从而使溶液显碱性。答案为:碱
理由是B2-+H2O![]() HB-+OH-。答案为:B2-+H2O
HB-+OH-。答案为:B2-+H2O![]() HB-+OH-
HB-+OH-
(2)因为H2B=H++HB-,所以0.1mol/LH2B溶液中c(H+)=0.1mol·L-1,因为第一步电离产生的H+会对第二步电离产生影响,所以第二步电离产生的c(H+)<0.01mol·L-1,故0.1mol/LH2B溶液中氢离子浓度可能<0.11mol/L。答案为:<
理由是第一步电离产生的H+抑制了第二步的电离
答案为:第一步电离产生的H+抑制了第二步的电离

练习册系列答案
相关题目