题目内容
【题目】用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4L CCl4含有的分子数为1NA
B.通常状况下,NA个CO2分子占有的体积为22.4L
C.常温常压下,1.06g Na2CO3溶于水,溶液中含Na+离子数为0.02NA
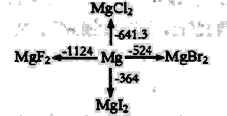
D.浓度为0.5mol/L的MgCl2溶液中,含有Cl数为NA个
【答案】C
【解析】
A选项,标准状况下,CCl4是液体,不能用气体摩尔体积进行计算,故A错误;
B选项,通常状况下,不是标准状况下,因此NA个CO2分子占有的体积不等于22.4L,故B错误;
C选项,1.06g Na2CO3物质的量![]() ,溶于水中,溶液中含Na+离子数为0.02NA,故C正确;
,溶于水中,溶液中含Na+离子数为0.02NA,故C正确;
D选项,浓度为0.5mol/L的MgCl2溶液中,溶液无体积,无法计算,故D错误。
综上所述,答案为C。

 考前必练系列答案
考前必练系列答案【题目】下图是某工业生产过程。

溶解度表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 55.2 | 65.6 | 71.3 | 77.3 |
硫酸铵 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 98 | 103 |
硫酸钾 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 |
氯化钾 | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 53.9 | 56.3 |
(1)本工业生产过程的目标产品是____________________________________。(写化学式)
(2)过滤Ⅰ操作所得固体中,除CaCO3外还有一种物质,该固体的用途有_________(试举一例)。
(3)根据溶解度表转化Ⅱ适宜的温度是________
A、0~10℃ B、20~30℃ C、40~60℃ D、90~100℃
过滤Ⅱ操作所得滤渣是__________。
(4)我国著名的化学家也利用了转化Ⅱ的反应原理制备了一种重要的碱,该制备的化学反应方程式为:___________________________________________________
(5)氯化钙结晶水合物(CaCl2·6H2O)进行脱水处理可制得常用的干燥剂,根据下图选择最佳脱水的方法是__________

A、氯化氢气流中加热到174℃ B、直接加热至174℃
C、直接加热至260℃ D、氯化氢气流中加热到260℃
(6)上述工业流程实现了绿色化学的理念,其中__________________(填化学式)实现了循环利用,副产品_________________________(填化学式)可转化为原料,整个流程基本实现了污染物零排放。
【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
反应前各物质的物质的量/mol
A | B | C | |
甲 | 1 | 3 | 0 |
乙 | 0 | 0 | 2 |
丙 | 1.5 | 4.5 | 1 |
A.乙中5min内C的反应速率为0.16mol-1·min-1
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D.达到平衡时,甲、乙两容器中C的物质的量相等