题目内容
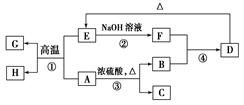
在半导体工业中有这样一句话:“从沙滩到用户”,其中由粗硅制纯硅的常用方法为:Si(粗)+2Cl2=SiCl4 SiCl4+2H2=Si(纯)+4HCl。若在25℃101KPa条件下反应生成HCl气体49L(注:25℃101KPa条件下气体摩尔体积为24.5L/mol)则:
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为 。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为 ,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为 。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是 t(保留两位小数)。
(1)反应生成HCl气体的质量为__________,转移电子的个数为_____________。
(2)反应生成的HCl气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为 。
(3)“从沙滩到用户”涉及到多个反应,其中制取粗硅的反应方程式为 ,纯净的石英砂与烧碱反应可以制得水玻璃,反应的离子方程式为 。
(4)普通玻璃若以氧化物形式表示其组成为(质量分数):Na2O 13%,CaO 11.7%,SiO2 75.3%。现以石灰石、纯碱和石英为原料生产这种玻璃10t,石灰石的利用率为80%,纯碱和石英的利用率为95%,至少需要上述原料的质量是 t(保留两位小数)。
(1)73g 4NA
(2)12mol/L
(3)SiO2+2C Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O
Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O
(4)12.65
(2)12mol/L
(3)SiO2+2C
 Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O
Si(粗)+2CO↑ SiO2+2OH-=SiO32-+H2O(4)12.65
试题分析:(1)25℃101KPa条件下气体摩尔体积为24.5L/mol,49L HCl气体的物质的量为2mol,其质量为2mol×36.5g/mol=73g,两个反应共转移电子个数为4NA。
(2)溶质质量为73g,水的质量为127g,所以溶液体积为200g/1.20g/mL=1/6L,则盐酸的物质的量浓度是2mol/1/6L=12mol/L。
(3)制取粗硅是用碳还原二氧化硅,其方程式为SiO2+2C
 Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
Si(粗)+2CO↑,石英的主要成分是SiO2,与烧碱反应制取水玻璃,反应的离子方程式为SiO2+2OH-=SiO32-+H2O。(4)10t这种玻璃中含Na2O1.3t,CaO1.17t,SiO27.53t,由CaCO3~CaO可计算出所需CaCO3的质量,同理可算出纯碱、石英的质量,约为12.65t。

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目