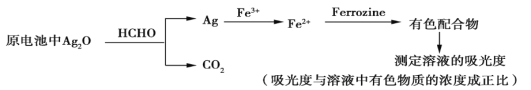
题目内容
【题目】不同温度下,水溶液中c(H+)与c(OH-)的关系如下图所示。下列有关说法不正确的是( )
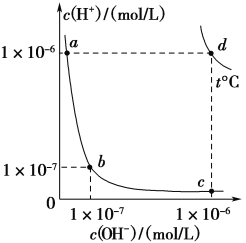
A. d点对应的食盐水pH=6,呈中性
B. 向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时c(Na+)=c(CH3COO-)
C. 温度为t ℃时,0.05 mol/L Ba(OH)2溶液的pH=11
D. a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
【答案】D
【解析】
本题考查水的离子积和影响水电离的因素的知识。根据水的离子积概念知,一定温度下,水溶液中c(H+)与c(OH-)乘积是个常数。水的离子积只受温度影响,升高温度,水的离子积增大,加酸加碱抑制水的电离,但离子积不会改变;溶液中阳离子所带的正电荷总数与阴离子带的正电荷总数相等。根据这些知识进行分析判断即可。
A.由题给图示,d点c(H+)=c(OH-)=1×10-6mol/L,溶液pH=6,呈中性,A.项正确;B.25 ℃时,向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,溶液pH=7呈中性,由电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(H+)=c(OH-),所以c(Na+)=c(CH3COO-),故B项正确;C.温度为t ℃时,KW=1×10-12,,0.05 mol/L的Ba(OH)2溶液中c(OH-)=0.1 mol/L,c(H+)=![]() =1×10-11mol/L,pH=11,C项正确;D.a点对应的稀硫酸中c(H+)=1×10-6mol/L,c(OH-)=1×10-8mol/L,水电离出的c(H+)=c(OH-)=1×10-8mol/L,水的电离受到抑制,c点对应的CH3COONa溶液中水的电离受到促进,水电离出的c(H+)=c(OH-)=1×10-6mol/L,D项说法错误。
=1×10-11mol/L,pH=11,C项正确;D.a点对应的稀硫酸中c(H+)=1×10-6mol/L,c(OH-)=1×10-8mol/L,水电离出的c(H+)=c(OH-)=1×10-8mol/L,水的电离受到抑制,c点对应的CH3COONa溶液中水的电离受到促进,水电离出的c(H+)=c(OH-)=1×10-6mol/L,D项说法错误。